题目内容
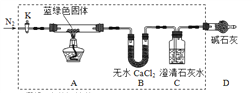
【题目】某同学为了检验浓硫酸与木炭粉在加热条件下反应:![]() ,产生的所有气体产物,选用了下图所示实验装置。
,产生的所有气体产物,选用了下图所示实验装置。
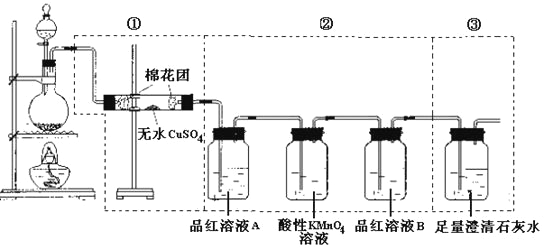
(1)①中无水硫酸铜的作用是___________。
(2)②中酸性KMnO4溶液的作用是______________________。
(3)②中两次用到品红溶液,它们的作用分别是A________、B________。
(4)③中发生反应的离子方程式是_____________。
【答案】 检验是否有水蒸气 除SO2 检验是否有SO2 检验SO2是否除尽 CO32-+Ca2++2OH- = CaCO3↓+ H2O
【解析】(1)一般检验含有水汽的混合气体,水通常是第一个检验的;实验利用白色硫酸铜遇到水变为蓝色证明含有水蒸气,①中无水硫酸铜的作用是检验反应生成的水蒸气;(2)因SO2和CO2都能使石灰水变浑浊,因此要想检验出CO2,就要先把SO2检验了,并除掉SO2,这样石灰水变浑浊才能说明有CO2,即②一定要在③的前面.根据检验SO2和CO2时,就要先把SO2检验了,并除掉SO2,这样石灰水变浑浊才能说明有CO2,所以高锰酸钾溶液是吸收二氧化硫的作用;(3)根据检验SO2和CO2时,就要先把SO2检验了,并除掉SO2,这样石灰水变浑浊才能说明有CO2,所以②中两次用到品红溶液,它们的作用分别是检验生成的SO2气体;检验SO2是否除尽;故答案为:检验生成的SO2气体;检验SO2是否除尽;(4)③装置是验证二氧化硫气体除净后,检验二氧化碳气体存在的实验装置,反应的离子方程式为:CO32-+Ca2++2OH- = CaCO3↓+ H2O。

【题目】X、Y、Z、M、Q、R是6种短周期元素,其原子半径及主要化合价如下:
元素代号 | X | Y | Z | M | Q | R |
原子半径/nm | 0.160 | 0.143 | 0.102 | 0.089 | 0.074 | 0.037 |
主要化合价 | +2 | +3 | +6,-2 | +2 | -2 | +1 |
(1)Z在元素中期表中的位置是______________________________。
(2)X、Y、Q各自形成简单离子,其中离子半径最大的是__________(填离子符号)。
(3)周期表中有些处于对角线(左上→右下)位置的元素,它们的单质及其化合物的性质相似,则M的氧化物与强碱溶液反应的离子方程式______________________________。
(4)Q和R按原子个数比1:1组成的化合物甲是一种“绿色”氧化剂。
①甲中所含共价键类型是____________________。
②空气阴极法电解制备甲的装置如图所示。在碱性溶液中,利用空气中的氧气还原得到甲和稀碱的溶液。图中a是__________极,阴极的电极反应式是____________________。