题目内容
将一定量的CH4、O2和Na2O2放入一密封容器中,用电火花不断引燃混合气体,使其充分反应,反应结束后,容器内压强趋于0(固体物质蒸发不计),其残余固体溶于水无气体放出.
(1)有关Na2O2反应的化学方程式是______.
(2)CH4、O2、Na2O2的物质的量之比是______.
(3)若混合气体中CH4为0.1mol,充分反应后,向残余固体中加足量的酸,能放出气体的物质的量是______.
解:(1)甲烷燃烧生成水和二氧化碳,过氧化钠与二氧化碳反应生成碳酸钠和氧气,该反应为2Na2O2+2CO2=2Na2CO3+O2,过氧化钠与水反应生成氢氧钠和氧气的化学反应为
2Na2O2+2H2O=4NaOH+O2↑,故答案为:2Na2O2+2CO2=2Na2CO3+O2;2Na2O2+2H2O=4NaOH+O2↑;
(2)依题意,最后产物只能是Na2CO3和NaOH的混合物,根据原子守恒原理(尤其是CH4中C和H原子个数比为1:4),可得
2CH4+O2+6Na2O2→2Na2CO3+8NaOH,三者物质的量之比为2:1:6,故答案为:2:1:6;
(3)加酸后气体只有CO2,由C原子守恒可得,生成气体的物质的量为0.1mol,故答案为:0.1mol.
分析:(1)根据过氧化钠与二氧化碳反应生成碳酸钠和氧气;过氧化钠与水反应生成氢氧钠和氧气;
(2)根据压强为0Pa,残留物溶于水,无气体逸出,说明 Na2O2已反应完全,可写出:6Na2O2+O2+2CH4→2Na2CO3+8NaOH;
(3)根据加酸后气体只有CO2,由C原子守恒进行计算.
点评:本题考查了过氧化钠与二氧化碳、水反应,若按常规方法,计算比较繁琐,而根据题目信息写出化学方程式则非常方便.
2Na2O2+2H2O=4NaOH+O2↑,故答案为:2Na2O2+2CO2=2Na2CO3+O2;2Na2O2+2H2O=4NaOH+O2↑;
(2)依题意,最后产物只能是Na2CO3和NaOH的混合物,根据原子守恒原理(尤其是CH4中C和H原子个数比为1:4),可得
2CH4+O2+6Na2O2→2Na2CO3+8NaOH,三者物质的量之比为2:1:6,故答案为:2:1:6;
(3)加酸后气体只有CO2,由C原子守恒可得,生成气体的物质的量为0.1mol,故答案为:0.1mol.
分析:(1)根据过氧化钠与二氧化碳反应生成碳酸钠和氧气;过氧化钠与水反应生成氢氧钠和氧气;
(2)根据压强为0Pa,残留物溶于水,无气体逸出,说明 Na2O2已反应完全,可写出:6Na2O2+O2+2CH4→2Na2CO3+8NaOH;
(3)根据加酸后气体只有CO2,由C原子守恒进行计算.
点评:本题考查了过氧化钠与二氧化碳、水反应,若按常规方法,计算比较繁琐,而根据题目信息写出化学方程式则非常方便.

练习册系列答案
相关题目
(12分)欲探究某矿石可能是由FeCO3、SiO2、Al2O3中的一种或几种组成,探究过程如下图所示。已知:碳酸不能溶解Al(OH)3沉淀。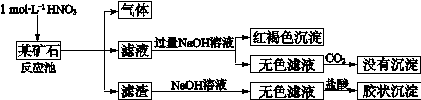
(1)Si在周期表中的位置是 。
(2)下列说法正确的是 。
| a.酸性:H2CO3>H2SiO3 | b.原子半径:O<C<Si<Al |
| c.稳定性:H2O>CH4>SiH4 | d.离子半径:O2-<Al3+ |
(4)该矿石和1 mol L-1HNO3反应的离子方程式 。
(5)工业上依据上述实验原理处理该矿石,将反应池逸出的气体与一定量的O2混合循环通入反应池中,目的是 ;若处理该矿石2.36×103 kg,得到滤渣1.2×103 kg,理论上至少需要1 mol L-1 HNO3的体积为 L。
