题目内容
【题目】Q、X、Y、Z、W五种元素的原子序数依次递增,W为第四周期元素,其余均为短周期主族元素。已知:
①Q原子的最外层电子数是次外层电子数的2倍;
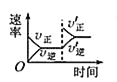
②Y、Z同主族,Y原子价电子排布图为![]()
③W元素基态原子的M层全充满,N层没有成对电子,只有一个未成对电子。
请回答下列问题:
(1)W的元素名称为________,其基态原子的电子排布式为_________。
(2)具有相同价电子数和相同原子数的分子或离子具有相同的结构特征,这一原理称为“等电子原理”,五种元素中电负性最强的非金属元素形成的一种单质A与Y、Z形成的化合物B是等电子体物质,A、B分子式分别为____________、____________。
(3)Q、X、Y三种元素的第一电离能最大的是_______(填元素符号)。
【答案】铜元素 1s22s22p63s23p63d104s1(或[Ar]3d104s1) O3 SO2 N
【解析】
Q、X、Y、Z、W五种元素的原子序数依次递增,W为第四周期元素,其余均为短周期主族元素,Q原子的最外层电子数是次外层电子数的2倍,则Q的电子层结构为2,4,Q为C元素;Y原子价电子排布图为![]() ,则Y为O元素,Y、Z同主族,则Z为S元素;X位于C和O之间,则X为N元素;W元素基态原子的M层全充满,N层没有成对电子,只有一个未成对电子,则其核外电子排布为1s22s22p63s23p63d104s1,为Cu元素。
,则Y为O元素,Y、Z同主族,则Z为S元素;X位于C和O之间,则X为N元素;W元素基态原子的M层全充满,N层没有成对电子,只有一个未成对电子,则其核外电子排布为1s22s22p63s23p63d104s1,为Cu元素。
(1)根据分析可知W为铜元素,基态铜原子的核外电子排布为1s22s22p63s23p63d104s1(或[Ar]3d104s1);
(2)非金属性越强,电负性越强,五种元素中非金属性最强的是O元素,所以O元素的电负性最强,O元素可以形成单质O2和O3,O元素和S元素可以形成化合物SO2和SO3,其中O3和SO2为等电子体,所以A为O3,B为SO2;
(3)Q、X、Y分别为C、N、O,三种元素位于同一周期,同周期自左至右第一电离能呈增大的趋势,虽然O比N位置靠右,但N原子最高能级电子为半满状态,更稳定,所以其第一电离能大于O,所以三种元素中第一电离能最大的是N。

 千里马走向假期期末仿真试卷寒假系列答案
千里马走向假期期末仿真试卷寒假系列答案【题目】铁氧体是一种磁性材料,具有广泛的应用。
(1)基态铁原子的核外电子排布式为________。
(2)工业制备铁氧体常使用水解法,制备时常加入尿素[CO(NH2)2 ]、醋酸钠等碱性物质。尿素分子中四种不同元素的电负性由大至小的顺序是__________;醋酸钠中碳原子的杂化类型是______。
(3)工业制备铁氧体也可使用沉淀法,制备时常加入氨(NH3)、联氨(N2H4)等弱碱。比较下表中氨(NH3)、联氨(N2H4)的熔沸点,解释其高低的主要原因:___________。
物质 | N2H4 | NH3 |
熔点/℃ | 2 | -77.8 |
沸点/℃ | 113.5 | -33.5 |
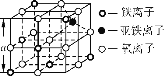
(4)Fe3O4晶体晶胞如图所示,计算Fe3O4晶体的密度________g·cm-3。 (图中a=0.42 nm,计算结果保留两位有效数字)