题目内容
工业废水中常含有一定量的Cr2O72-和CrO42-,它们会对生态系统造成很大的损害,其中还原沉淀法是常用的一种处理方法。流程如下:


其中第①步中存在平衡:2CrO42-(黄色)+2H+ Cr2O72-(橙色)+H2O。下列有关说法正确的是
Cr2O72-(橙色)+H2O。下列有关说法正确的是
A.第①步当2c (Cr2O72-)=c(CrO42-)时,达到了平衡状态
B.对于上述平衡,加入适量稀硫酸后,溶液颜色变黄色,则有利于CrO42-的生成
C.Cr(OH)3是一种两性氢氧化物,所以像Al(OH)3一样能溶于氨水和碳酸溶液中
D.第②步中,还原0.1 mol Cr2O72-需要91.2 g FeSO4
D
【解析】
试题分析:没有说明v(Cr2O72—)和v(CrO42—)表示的方向,所以无法判断是否平衡,A错;加酸后,平衡右移,颜色将会变成橙色,有利于Cr2O72—的生成,B错;Al(OH)3是两性氢氧化物,但不溶于弱酸弱碱,故C错误。;还原0.1molCr2O72—需要0.6molFeSO4,所以需要91.2gFeSO4,故D正确。
考点:平衡状态的标志,平衡的移动影响因素,两性氢氧化物的性质,氧化还原反应。

练习册系列答案
 全能测控期末小状元系列答案
全能测控期末小状元系列答案
相关题目
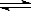 F—(aq) + H2O(l) △H=-67.7 kJ/mol
F—(aq) + H2O(l) △H=-67.7 kJ/mol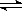 H+(aq)+OH—(aq);△H= +57.3kJ/mol
H+(aq)+OH—(aq);△H= +57.3kJ/mol Na++ HSO4-
Na++ HSO4-