题目内容
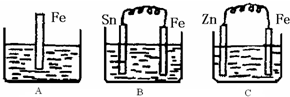
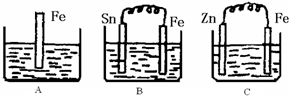
A、B、C 三个烧杯中分别盛有相同物质的量浓度的稀硫酸.

(1)A中反应的离子方程式为
(2)C中被腐蚀的金属是

(1)A中反应的离子方程式为
Fe+2H+=Fe2++H2↑
Fe+2H+=Fe2++H2↑
,B中Cu极电极反应式为2H++2e-→H2↑
2H++2e-→H2↑
.(2)C中被腐蚀的金属是
Zn
Zn
,总反应方程式为Zn+H2SO4=ZnSO4+H2↑
Zn+H2SO4=ZnSO4+H2↑
,A.B、C中铁被腐蚀的速率,由大到小的顺序是B>A>C
B>A>C
.分析:(1)金属铁和硫酸直接接触会发生置换反应,原电池中,正极发生还原反应;
(2)原电池中的总反应即为自发的氧化还原反应,负极金属被腐蚀,金属的腐蚀速率:原电池的负极金属>金属的化学腐蚀>有保护措施的腐蚀.;
(2)原电池中的总反应即为自发的氧化还原反应,负极金属被腐蚀,金属的腐蚀速率:原电池的负极金属>金属的化学腐蚀>有保护措施的腐蚀.;
解答:解:(1)金属铁和硫酸之间会发生置换反应,原理是:Fe+2H+=Fe2++H2↑,B中Cu极电极为正极,电解质中的氢离子得电子,发生还原反应,即2H++2e-→H2↑,
故答案为:Fe+2H+=Fe2++H2↑;2H++2e-→H2↑;
(2)Zn、Fe、硫酸构成的原电池,金属锌为负极,总的电池反应为:Zn+H2SO4=ZnSO4+H2↑,根据金属的腐蚀速率关系:铁做原电池的负极(B)>金属铁的化学腐蚀(A)>有保护措施的腐蚀(C,金属铁做原电池的正极,被保护),故答案为:Zn;Zn+H2SO4=ZnSO4+H2↑;B>A>C.
故答案为:Fe+2H+=Fe2++H2↑;2H++2e-→H2↑;
(2)Zn、Fe、硫酸构成的原电池,金属锌为负极,总的电池反应为:Zn+H2SO4=ZnSO4+H2↑,根据金属的腐蚀速率关系:铁做原电池的负极(B)>金属铁的化学腐蚀(A)>有保护措施的腐蚀(C,金属铁做原电池的正极,被保护),故答案为:Zn;Zn+H2SO4=ZnSO4+H2↑;B>A>C.
点评:本题考查学生原电池的工作原理以及金属的腐蚀速率知识,可以根据所学知识进行回答,难度不大.

练习册系列答案
 口算题卡北京妇女儿童出版社系列答案
口算题卡北京妇女儿童出版社系列答案
相关题目
 2Z
2Z
 如图所示,A、B、C三个烧杯中分别盛有相同物质的量浓度的稀硫酸(B、C中金属棒分别用导线连接).
如图所示,A、B、C三个烧杯中分别盛有相同物质的量浓度的稀硫酸(B、C中金属棒分别用导线连接).