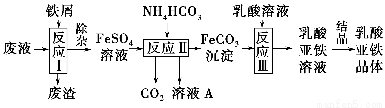
题目内容
下列是部分矿物资源的利用及产品流程,有关说法不正确的是( )。

A.粗铜电解精炼时,粗铜做阳极
B.生产铝、铜、高纯硅及玻璃过程中都涉及氧化还原反应
C.黄铜矿冶铜时,副产物SO2可用于生产硫酸,FeO可用做冶铁的原料
D.粗硅制高纯硅时,提纯四氯化硅可用多次分馏的方法
B
【解析】 电解精炼铜时,粗铜作阳极,发生氧化反应,A正确;制备单质时涉及氧化还原反应,制玻璃的反应是SiO2+Na2CO3 Na2SiO3+CO2和SiO2+CaCO3
Na2SiO3+CO2和SiO2+CaCO3 CaSiO3+CO2,均不属于氧化还原反应,B错误;SO2可以转化成SO3,进而生成H2SO4,FeO与CO在高温下可生成Fe,C正确;制备硅的过程中,利用沸点不同进行分馏,将SiCl4从杂质中提取出来,再与H2发生置换反应得到高纯硅,D正确。
CaSiO3+CO2,均不属于氧化还原反应,B错误;SO2可以转化成SO3,进而生成H2SO4,FeO与CO在高温下可生成Fe,C正确;制备硅的过程中,利用沸点不同进行分馏,将SiCl4从杂质中提取出来,再与H2发生置换反应得到高纯硅,D正确。

练习册系列答案
 学而优衔接教材南京大学出版社系列答案
学而优衔接教材南京大学出版社系列答案
相关题目