题目内容
近年来,化学工作者在C、N的应用研究上取得了一些重要成果.
(1)已知:CH3OH(l)+
O2(g)=CO2(g)+2H2O△H=-725.76kJ/mol
CH3OCOOCH3(l)+3O2(g)=3CO2(g)+3H2O△H=-1299.80kJ/mol
则2CH3OH(l)+CO2(g)=CH3OCOOCH3(l)+H2O(l)△H= .
(2)在载人航天器的生态系统中,不仅要求分离去除CO2,还要求提供充足的O2.某种电化学装置可实现如下转化:2CO2=2CO+O2,CO可用作燃料.已知该反应的阳极反应为:4OH--4e-=O2↑+2H2O,则阴极反应为 .有人提出,可以设计反应2CO=2C+O2(△H>0)来消除CO的污染.请你判断上述反应是否能自发进行,并说明理由 .
(3)将CO2和H2在催化剂作用下合成CH3OH.一定温度下,在一体积为1L密闭容器中投1mol CO2和3mol H2发生如下反应:CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H<0在温度T1时,当反应达到平衡时,测得n(H2)=2.4mol;其它条件不变,在温度T2时,当反应达到平衡时,测得n(CO2)=0.82mol,则T2 T1.(填“>”、“<”或“=”)
(4)汽车安全气囊是行车安全的重要保障.当车辆发生碰撞的瞬间,安全装置通电点火使其中的固体粉末分解释放出大量的氮气形成气囊,从而保护司机及乘客免受伤害.为研究安全气囊工作的化学原理,取安全装置中的固体粉末进行实验.经组成分析,确定该粉末仅含Na、Fe、N、O四种元素.水溶性试验表明,固体粉末部分溶解,经检测,可溶物为化合物甲;不溶物为红棕色固体,可溶于盐酸.取13.0g化合物甲,加热使其完全分解,生成氮气和单质乙,生成的氮气折合成标准状况下的体积为6.72L.单质乙在高温隔绝空气的条件下与不溶物红棕色粉末反应生成化合物丙和另一种单质.化合物丙与空气接触可转化为可溶性盐.
请回答下列问题:
a.甲的化学式为 ,丙的电子式为 .
b.若丙在空气中转化为碳酸氢盐,则反应的化学方程式为 .
c.单质乙与红棕色粉末发生反应的化学方程式为 ,安全气囊中红棕色粉末的作用是 .
d.以下物质中,有可能作为安全气囊中红棕色粉末替代品的是 .
A.KCl B.KNO3 C.Na2S D.CuO.
(1)已知:CH3OH(l)+
| 3 |
| 2 |
CH3OCOOCH3(l)+3O2(g)=3CO2(g)+3H2O△H=-1299.80kJ/mol
则2CH3OH(l)+CO2(g)=CH3OCOOCH3(l)+H2O(l)△H=
(2)在载人航天器的生态系统中,不仅要求分离去除CO2,还要求提供充足的O2.某种电化学装置可实现如下转化:2CO2=2CO+O2,CO可用作燃料.已知该反应的阳极反应为:4OH--4e-=O2↑+2H2O,则阴极反应为
(3)将CO2和H2在催化剂作用下合成CH3OH.一定温度下,在一体积为1L密闭容器中投1mol CO2和3mol H2发生如下反应:CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H<0在温度T1时,当反应达到平衡时,测得n(H2)=2.4mol;其它条件不变,在温度T2时,当反应达到平衡时,测得n(CO2)=0.82mol,则T2
(4)汽车安全气囊是行车安全的重要保障.当车辆发生碰撞的瞬间,安全装置通电点火使其中的固体粉末分解释放出大量的氮气形成气囊,从而保护司机及乘客免受伤害.为研究安全气囊工作的化学原理,取安全装置中的固体粉末进行实验.经组成分析,确定该粉末仅含Na、Fe、N、O四种元素.水溶性试验表明,固体粉末部分溶解,经检测,可溶物为化合物甲;不溶物为红棕色固体,可溶于盐酸.取13.0g化合物甲,加热使其完全分解,生成氮气和单质乙,生成的氮气折合成标准状况下的体积为6.72L.单质乙在高温隔绝空气的条件下与不溶物红棕色粉末反应生成化合物丙和另一种单质.化合物丙与空气接触可转化为可溶性盐.
请回答下列问题:
a.甲的化学式为
b.若丙在空气中转化为碳酸氢盐,则反应的化学方程式为
c.单质乙与红棕色粉末发生反应的化学方程式为
d.以下物质中,有可能作为安全气囊中红棕色粉末替代品的是
A.KCl B.KNO3 C.Na2S D.CuO.
考点:用盖斯定律进行有关反应热的计算,化学电源新型电池,常见金属元素的单质及其化合物的综合应用,无机物的推断
专题:化学反应中的能量变化,电化学专题,几种重要的金属及其化合物
分析:(1)依据热化学方程式 和盖斯定律计算得到;
(2)依据电解原理阴极上是得到电子发生还原反应生成一氧化碳;反应能否自发看△H-T△S的大小;
(3)依据平衡移动原理解答;
(4)a、根据题干信息推导出甲、乙、丙三种物质,由分解的甲的质量和产生的氮气体积确定甲的分子式,根据化合物的类型书写电子式;
b、根据物质的性质来书写化学方程式;
c、根据单质和红棕色粉末发生的置换反应来分析;
d、根据红棕色粉末氧化铁的作用来寻找可替代的物质.
(2)依据电解原理阴极上是得到电子发生还原反应生成一氧化碳;反应能否自发看△H-T△S的大小;
(3)依据平衡移动原理解答;
(4)a、根据题干信息推导出甲、乙、丙三种物质,由分解的甲的质量和产生的氮气体积确定甲的分子式,根据化合物的类型书写电子式;
b、根据物质的性质来书写化学方程式;
c、根据单质和红棕色粉末发生的置换反应来分析;
d、根据红棕色粉末氧化铁的作用来寻找可替代的物质.
解答:
解:(1)已知
①CH3OH(l)+
O2(g)=CO2(g)+2H2O(l)△H=-725.76kJ/mol
②CH3OCOOCH3(l)+3O2(g)=3CO2(g)+3H2O(l)△H=-1299.80kJ/mol
依据热化学方程式和盖斯定律①×2-②得到,2CH3OH(l)+CO2(g)=CH3OCOOCH3(l)+H2O(l)△H=-151.72KJ/mol,
故答案为:-151.72KJ/mol;
(2)以Pt为阳极,Pb(CO2的载体)为阴极,KHCO3溶液为电解质溶液,还原消除航天器内CO2同时产生O2和新的能源CO,总反应的化学方程式为:2CO2
2CO+O2,则二氧化碳在阴极上得到电子发生还原反应生成一氧化碳,的电极反应式为:CO2+H2O+2e-=CO+2OH-.
反应2CO=2C+O2(△H>0)中,△H>0,△S<0,所以△H-T△S>0,反应不能自发进行.
故答案为:CO2+H2O+2e-=CO+2OH-;不能,因为该反应的△H>0,△S<0所以不能自发;
(3)T1时H2反应了0.6mol,T2时CO2反应了0.18mol,H2就反应了0.54mol,说明T2时平衡向逆向移动了,又△H<0,说明T2>T1,故答案为:>;
(4)a、Na、Fe、N、O四种元素组成的化合物中为红棕色且可溶于盐酸的只有Fe2O3,在四种元素组成的单质中,可以在高温隔绝空气的条件下与Fe2O3反应的就只有金属钠了,因此单质乙是钠,化合物甲是由Na和N元素组成,13.0g化合物甲,加热使其完全分解,生成氮气和单质乙,生成的氮气折合成标准状况下的体积为6.72L,即0.3mol,经计算知Na和N的原子个数比是1:3,所以化合物甲的化学式为NaN3,是一种离子化合物,故电子式为: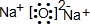 .
.
故答案为::NaN3;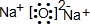 ;
;
b、因为丙是在高温隔绝空气的条件下生成的,在根据丙的性质可知丙只能是Na2O而不是Na2O2,反应的化学方程式为:Na2O+2CO2+H2O=2NaHCO3.
故答案为:Na2O+2CO2+H2O=2NaHCO3;
c、钠和氧化铁发生的置换反应方程式为:6Na+Fe2O3
2Fe+3Na2O,所以安全气囊中氧化铁粉末的作用是消耗产生的活泼的钠,避免分解产生的金属钠可能产生的危害.故答案为:6Na+Fe2O3
2Fe+3Na2O;避免分解产生的金属钠可能产生的危害;
d、安全气囊中氧化铁粉末的作用是消耗产生的活泼的钠,选项中能和钠反应的是硝酸钾和氧化铜,故答案为:BD.
①CH3OH(l)+
| 3 |
| 2 |
②CH3OCOOCH3(l)+3O2(g)=3CO2(g)+3H2O(l)△H=-1299.80kJ/mol
依据热化学方程式和盖斯定律①×2-②得到,2CH3OH(l)+CO2(g)=CH3OCOOCH3(l)+H2O(l)△H=-151.72KJ/mol,
故答案为:-151.72KJ/mol;
(2)以Pt为阳极,Pb(CO2的载体)为阴极,KHCO3溶液为电解质溶液,还原消除航天器内CO2同时产生O2和新的能源CO,总反应的化学方程式为:2CO2
| ||
反应2CO=2C+O2(△H>0)中,△H>0,△S<0,所以△H-T△S>0,反应不能自发进行.
故答案为:CO2+H2O+2e-=CO+2OH-;不能,因为该反应的△H>0,△S<0所以不能自发;
(3)T1时H2反应了0.6mol,T2时CO2反应了0.18mol,H2就反应了0.54mol,说明T2时平衡向逆向移动了,又△H<0,说明T2>T1,故答案为:>;
(4)a、Na、Fe、N、O四种元素组成的化合物中为红棕色且可溶于盐酸的只有Fe2O3,在四种元素组成的单质中,可以在高温隔绝空气的条件下与Fe2O3反应的就只有金属钠了,因此单质乙是钠,化合物甲是由Na和N元素组成,13.0g化合物甲,加热使其完全分解,生成氮气和单质乙,生成的氮气折合成标准状况下的体积为6.72L,即0.3mol,经计算知Na和N的原子个数比是1:3,所以化合物甲的化学式为NaN3,是一种离子化合物,故电子式为:
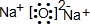 .
.故答案为::NaN3;
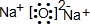 ;
;b、因为丙是在高温隔绝空气的条件下生成的,在根据丙的性质可知丙只能是Na2O而不是Na2O2,反应的化学方程式为:Na2O+2CO2+H2O=2NaHCO3.
故答案为:Na2O+2CO2+H2O=2NaHCO3;
c、钠和氧化铁发生的置换反应方程式为:6Na+Fe2O3
| ||
| ||
d、安全气囊中氧化铁粉末的作用是消耗产生的活泼的钠,选项中能和钠反应的是硝酸钾和氧化铜,故答案为:BD.
点评:本题跨度大,考查范围广,思维含量大,是一道难题.

练习册系列答案
 七星图书口算速算天天练系列答案
七星图书口算速算天天练系列答案 初中学业考试导与练系列答案
初中学业考试导与练系列答案
相关题目
 如图所示的装置,C、D、E、F、X、Y都是惰性电极.将电源接通后,向(乙)中滴入酚酞溶液,在F极附近显红色.则以下说法正确的是( )
如图所示的装置,C、D、E、F、X、Y都是惰性电极.将电源接通后,向(乙)中滴入酚酞溶液,在F极附近显红色.则以下说法正确的是( )| A、(甲)、(乙)装置的C、D、E、F电极均有单质生成,其物质的量比为1:2:2:2 |
| B、电源B极是正极 |
| C、欲用(丙)装置给铜镀银,G应该是Cu,电镀液选用AgNO3溶液 |
| D、装置(丁)中X极附近红褐色变浅,说明氢氧化铁胶粒带负电荷 |
主链上有7个碳原子,含甲基、乙基两个支链的烷烃有( )
| A、2种 | B、4种 | C、8种 | D、12种 |
下列说法中,正确的是( )
| A、原电池是将电能转化为化学能的装置 |
| B、在原电池中,正极上发生氧化反应 |
| C、在原电池中,电子从原电池的正极流向负极 |
| D、在原电池内部,阳离子向正极方向移动 |