题目内容
【题目】从铝土矿(主要成分是Al2O3,含SiO2、Fe2O3、MgO等杂质)中提取氧化铝两种工艺流程如下:
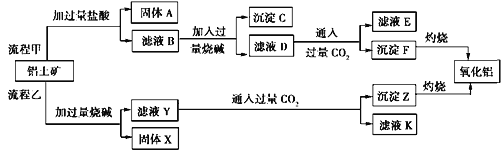
注:SiO2在“碱溶”时转化为铝硅酸钠沉淀。
请回答下列问题:
(1)验证滤液B含Fe3+,可取少量滤液并加入__________(填试剂名称)。
(2)滤液E、K中溶质的主要成份是________(填化学式),写出该溶质的一种用途____________。
(3)流程甲加入盐酸后生成Al3+的离子方程式为________。
(4)流程乙加入烧碱后生成SiO![]() 的离子方程式为____________________________。
的离子方程式为____________________________。
(5)滤液D中通过量CO2产生沉淀F的离子方程式:___________________________。
(6)已知298K时,Mg(OH)2的溶度积常数Ksp=5.6×10-12,取适量的滤液B,加入一定量的烧碱至达到沉淀溶解平衡,测得pH=13,则此温度下残留在溶液中的c(Mg2+)=________。
【答案】硫氰化钾或硫氰酸钾、苯酚溶液 NaHCO3 制纯碱或作发酵粉 Al2O3+6H+=2Al3++3H2O SiO2+2OH-=SiO32—+H2O AlO2- + CO2 +2H2O=Al(OH)3↓+HCO3- 5.6×10-10mol·L-
【解析】
由工艺流程甲可知,铝土矿与盐酸反应得固体A和滤液B,则固体A为SiO2,滤液B含有氯化铝、氯化铁、氯化镁等,滤液中加入过量的NaOH,可推知沉淀C为氢氧化铁、氢氧化镁,滤液D含有偏铝酸钠、氯化钠、氢氧化钠,所以向滤液D中通入过量二氧化碳,生成氢氧化铝沉淀与碳酸氢钠,沉淀F为Al(OH)3,滤液E中含有NaCl、NaHCO3;根据工艺流程乙可知,铝土矿中的Al2O3、SiO2能和氢氧化钠反应,可知固体X为Fe2O3、MgO等,滤液Y为硅酸钠、偏铝酸钠,滤液中通入过量二氧化碳,沉淀Z为Al(OH)3、硅酸,滤液K中含有NaHCO3,据此分析。
(1)要检验滤液B中含有Fe3+,方法很多,如可加入硫氰化钾溶液,溶液变为血红色;加入苯酚溶液,与苯酚发生显色反应,溶液为紫色;与碱溶液反应生成红褐色的氢氧化铁沉淀,都能证明滤液B中含有Fe3+,故答案为:硫氰化钾或硫氰酸钾、苯酚溶液。
(2)由分析可知滤液E、K中溶质的主要成份是NaHCO3,NaHCO3的用途很多,如治疗胃酸过多、发酵剂、灭火剂等,故答案为:NaHCO3,制纯碱或作发酵粉。
(3)流程甲加入盐酸后生成Al3+的物质是铝土矿中的氧化铝,反应的离子方程式为:Al2O3+6H+=2Al3++3H2O,故答案为:Al2O3+6H+=2Al3++3H2O。
(4)流程乙加入烧碱后,与氧化铝反应生成偏铝酸钠,与二氧化硅生成硅酸钠,生成SiO32-的离子方程式为SiO2+2OH-=SiO32—+H2O,故答案为:SiO2+2OH-=SiO32-+H2O。
(5)滤液D中的溶质为NaCl、NaAlO2、NaOH,向溶液中通入过量CO2,发生的反应为NaAlO2+CO2+2H2O=Al(OH)3↓+NaHCO3、NaOH+CO2=NaHCO3,产生沉淀F的离子方程式为:AlO2-+CO2+2H2O=Al(OH)3↓+HCO3-,故答案为:AlO2-+CO2+2H2O=Al(OH)3↓+HCO3-。
(6)pH=13时,c(OH-)=0.1mol·L-1,Ksp=c(Mg2+)·c2(OH-)=5.6×10-12,可得c(Mg2+)=5.6×10-10mol·L-1,故答案为:5.6×10-10mol·L-1。

【题目】在100℃时,将0.100mol的四氧化二氮气体充入1L 抽空的密闭容器中,隔一定时间对该容器内的物质进行分析,得到如下表格:
时间/s 浓度/mol·L-1 | 0 | 20 | 40 | 60 | 80 | 100 |
c(N2O4) | 0.100 | c1 | 0.050 | c3 | a | b |
c(NO2) | 0.000 | 0.060 | c2 | 0.120 | 0.120 | 0.120 |
试填空:
(1)该反应的化学方程式为_______________________________________;达到平衡时四氧化二氮的转化率为_____% ;表中 c2_____c3____a____b(选填“ > ”、“ < ”、“ = ”)。
(2)20s时四氧化二氮的浓度 c1=________mol·L-1,在0s~20s内四氧化二氮的平均反应速率为_______mol·(L·s)-1;
(3)若在相同情况下最初向该容器充入的是二氧化氮气体,要达到上述同样的平衡状态,二氧化氮的起始浓度是____mol·L-1。
