题目内容
图表法、图象法是常用的科学研究方法.阅读下列图表回答问题: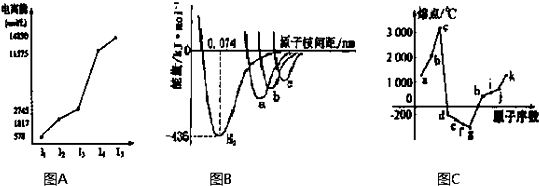
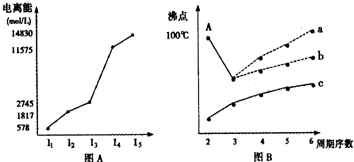
(1)图A是第三周期某主族元素M的电离能变化情况的图象.则M元素位于周期表的
(2)图B是表示H2、Cl2、Br2、I2四种分子形成过程中能量随核间距的变化情况的图象,其中表示I2的曲线的是
(3)图C是1~18号元素中部分连号元素单质的熔点变化情况图,其中c点代表的单质是
分析:(1)电离能是元素的原子失去电子所需要的能量,根据电离能的大小确定最外层电子数,进而确定所处的族序数;同一周期从左到右元素第一电离能呈增大趋势,但ⅡA、ⅤA族元素比左右元素高;
(2)图B是表示H2、Cl2、Br2、I2四种分子形成过程中能量随核间距的变化情况的图象,其中表示I2的曲线的是c 理由是Cl、Br、I三种原子中,I元素的原子半径最大,原子间形成分子时键长最大.(3)图C中,处于峰顶的c、k应分别是C、Si两元素属于原子晶体的单质,据此解答.
(2)图B是表示H2、Cl2、Br2、I2四种分子形成过程中能量随核间距的变化情况的图象,其中表示I2的曲线的是c 理由是Cl、Br、I三种原子中,I元素的原子半径最大,原子间形成分子时键长最大.(3)图C中,处于峰顶的c、k应分别是C、Si两元素属于原子晶体的单质,据此解答.
解答:解:(1)电离能是元素的原子失去电子所需要的能量,根据图A可以知道,元素的第三电离能之后数据相当大,说明易失去三个电子,最外层电子数为3,故为第ⅢA的元素; 同一周期从左到右元素第一电离能呈增大趋势,但ⅡA、ⅤA族元素比左右元素高,故第一电离能 Na<M<Mg,故答案为:IIIA;Na;Mg;
(2)图B是表示H2、Cl2、Br2、I2四种分子形成过程中能量随核间距的变化情况的图象,其中表示I2的曲线的是c 理由是Cl、Br、I三种原子中,I元素的原子半径最大,原子间形成分子时键长最大,故答案为:c;Cl、Br、I三种原子中,I元素的原子半径最大,原子间形成分子时键长最大;
(3)图C中,处于峰顶的c、k应分别是C、Si两元素属于原子晶体的单质,金刚石是原子晶体,碳碳键键能很大,所以熔点很高(石墨是混合型晶体,但在每层内碳与碳以共价键相结合,键能很大,故熔点很高).
故答案为:金刚石(石墨);金刚石是原子晶体,碳碳键键能很大,所以熔点很高(石墨是混合型晶体,但在每层内碳与碳以共价键相结合,键能很大,故熔点很高).
(2)图B是表示H2、Cl2、Br2、I2四种分子形成过程中能量随核间距的变化情况的图象,其中表示I2的曲线的是c 理由是Cl、Br、I三种原子中,I元素的原子半径最大,原子间形成分子时键长最大,故答案为:c;Cl、Br、I三种原子中,I元素的原子半径最大,原子间形成分子时键长最大;
(3)图C中,处于峰顶的c、k应分别是C、Si两元素属于原子晶体的单质,金刚石是原子晶体,碳碳键键能很大,所以熔点很高(石墨是混合型晶体,但在每层内碳与碳以共价键相结合,键能很大,故熔点很高).
故答案为:金刚石(石墨);金刚石是原子晶体,碳碳键键能很大,所以熔点很高(石墨是混合型晶体,但在每层内碳与碳以共价键相结合,键能很大,故熔点很高).
点评:本题对物质结构与性质进行综合性考查,难度中等,侧重考查学生运用所学知识对图表、图象分析.

练习册系列答案
 浙江之星课时优化作业系列答案
浙江之星课时优化作业系列答案 激活思维优加课堂系列答案
激活思维优加课堂系列答案
相关题目
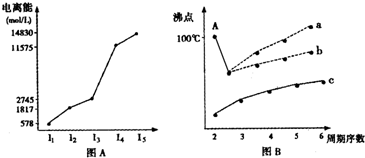


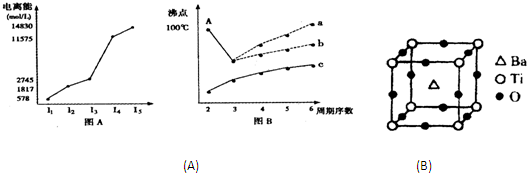
 图表法、图象法是常用的科学研究方法.
图表法、图象法是常用的科学研究方法.