题目内容
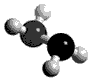
肼(N2H4)分子它的沸点高l13℃,燃烧热为642 kJ·mol-1,肼与氧气及氢氧化钾溶液还可构成燃电池。已知肼的球棍模型如图所示,下列有关说法正确的是

- A.肼分子中所有原子都达到8电子的稳定结构
- B.肼-氧气燃料电池,负极的电极反应为:O2 +2H2O+4e-=4OH-
- C.肼燃烧的热化学方程式为:N2H4(g)+O2(g) = N2(g) +2H2O(g);△H=-642 kJ·mol-1
- D.肼沸点高达l13℃,可推测肼分子间可形成氢键
D
肼分子中氢原子不可能达到8电子稳定结构,A不正确。在燃料电池中,氧气得电子,在正极通入,B不正确。燃烧热是指在一定条件下,1mol可燃物完全燃烧生成稳定的氧化物时所放出的能量,所以X是错误的。氮元素的非金属性强,可以形成氢键,因此正确的答案是D。
肼分子中氢原子不可能达到8电子稳定结构,A不正确。在燃料电池中,氧气得电子,在正极通入,B不正确。燃烧热是指在一定条件下,1mol可燃物完全燃烧生成稳定的氧化物时所放出的能量,所以X是错误的。氮元素的非金属性强,可以形成氢键,因此正确的答案是D。

练习册系列答案
 黄冈天天练口算题卡系列答案
黄冈天天练口算题卡系列答案
相关题目