题目内容
【题目】某课外小组采用碘量法测定河水中的溶解氧。实验步骤及测定原理如下:
Ⅰ.取样、氧的固定
用溶解氧瓶采集水样。记录大气压及水体温度。将水样与Mn(OH)2碱性悬浊液(含有KI)混合,反应生成MnO(OH)2,实现氧的固定。
Ⅱ.酸化、滴定
将固氧后的水样酸化,MnO(OH)2被I还原为Mn2+,在暗处静置5 min,然后用标准Na2S2O3溶液滴定生成的I2(2![]() +I2 = 2I+
+I2 = 2I+![]() )。
)。
回答下列问题:
(1)取水样时应尽量避免扰动水体表面,这样操作的主要目的是_____。
(2)“氧的固定”中发生反应的化学方程式为___________。
(3)Na2S2O3能水解,则滴定时Na2S2O3溶液应装在_____(填下图中的仪器编号)。请补充润洗该仪器的操作方法:从滴定管____加入3~5mL所要盛装的溶液,__________,然后,一手控制活塞(酸式滴定管轻轻转动活塞;碱式滴定管轻轻挤压玻璃球),将液体从滴定管__放入预置的烧杯中。
甲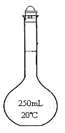 乙
乙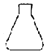 丙
丙![]() 丁
丁![]()
(4)某次滴定前滴定管液面如图所示,读数为________mL。
![]()
(5)量取100.00 mL水样经固氧、酸化后,从中取20.00 mL放入锥形瓶,用a mol·L1Na2S2O3溶液滴定,以淀粉溶液作指示剂,终点现象为________________;若消耗Na2S2O3溶液的体积为b mL,则水样中溶解氧的含量为__mg·L1。
【答案】使测定值与水体中的实际值保持一致,避免产生误差 O2 + 2Mn(OH)2=2MnO(OH)2 丁 上口 倾斜着转动滴定管 下口 0.30 蓝色刚好褪去 400ab
【解析】
(1)采集的水样中溶解的氧气因外界条件的改变其溶解度发生变化;
(2)“氧的固定”的方法是用Mn(OH)2碱性悬浊液(含有KI)与水样混合,反应生成MnO(OH)2;
(3)Na2S2O3能水解显碱性,可装在碱式滴定管中进行滴定,将溶液从滴定管的上口倒入滴定管中进行润洗,完全排出溶液;
(4)滴定管读数上小下大,精确度为0.01mL;
(5)用标准Na2S2O3溶液滴定生成的I2,用淀粉作指示剂,一开始I2遇淀粉变蓝,随着反应的进行,蓝色逐渐变浅,直至最终达到滴定终点时蓝色完全消失;根据关系O2~2MnO(OH)2~2I2~4S2O32-进行基本计算。
(1)取水样扰动水体表面,这样操作会使氧气溶解度减小,为此,取水样时应尽量避免扰动水体表面,避免产生误差;
(2)“氧的固定”的方法是用Mn(OH)2碱性悬浊液(含有KI)与水样混合,反应生成MnO(OH)2,反应的方程式为:O2 + 2Mn(OH)2=2MnO(OH)2;
(3)Na2S2O3能水解,使溶液显碱性,可装在碱式滴定管中进行滴定,将溶液从滴定管的上口倒入滴定管中倾斜着转动滴定管进行润洗,从下口将液体从滴定管排入预置的烧杯中;
(4)滴定管读数上小下大,精确度为0.01mL,图中读数为0.30mL;
(5)用标准Na2S2O3溶液滴定生成的I2,用淀粉作指示剂,一开始I2遇淀粉变蓝,随着反应的进行,蓝色逐渐变浅,直至最终达到滴定终点时蓝色完全消失,且30s内不变色;根据O2 + 2Mn(OH)2=2MnO(OH)2、MnO(OH)2+2I-+4H+=I2+ Mn2++3H2O、2![]() +I2=2I+
+I2=2I+![]() 可得关系式:O2~2MnO(OH)2~2I2~4S2O32-,则有n(O2)=
可得关系式:O2~2MnO(OH)2~2I2~4S2O32-,则有n(O2)=![]() ,则水样中溶解氧的含量为
,则水样中溶解氧的含量为![]() =400mg·L1。
=400mg·L1。

 挑战100单元检测试卷系列答案
挑战100单元检测试卷系列答案