题目内容
【题目】以反应![]() 为例探究“外界条件对化学反应速率的影响"。实验时,分别量取
为例探究“外界条件对化学反应速率的影响"。实验时,分别量取![]() 溶液和酸性
溶液和酸性![]() 溶液,迅速混合并开始计时,通过测定溶液褪色所需时间来判断反应的快慢。
溶液,迅速混合并开始计时,通过测定溶液褪色所需时间来判断反应的快慢。
编号 |
| 酸性 | 温度/℃ | ||
浓度 | 体积 | 浓度 | 体积 | ||
① | 0.10 | 2.0 | 0.01 | 4.0 | 25 |
② | 0.20 | 2.0 | 0.01 | 4.0 | 25 |
③ | 0.20 | 2.0 | 0.01 | 4.0 | 50 |
下列说法不正确的是( )
A.实验①、②、③所加的![]() 溶液均要过量
溶液均要过量
B.实验①测得![]() 溶液的褪色时间为40 s,则这段时间内平均反应速率
溶液的褪色时间为40 s,则这段时间内平均反应速率![]()
C.实验①和②探究浓度对反应速率的影响,实验②、③探究温度对反应速率的影响
D.3组实验中均发现起初反应较慢,过了一会儿速率突然增大,可能是生成的![]() 对反应起催化作用
对反应起催化作用
【答案】B
【解析】
A. 根据反应方程式![]() 并结合实验数据可知,在这三个实验中所加
并结合实验数据可知,在这三个实验中所加![]() 溶液均过量,故A正确;
溶液均过量,故A正确;
B. 高锰酸钾完全反应,混合后溶液中高锰酸钾的浓度为:0.010mol/L×0.004L/(0.002L+0.004L)=2/3×0.010mol/L,这段时间内平均反应速率v(KMnO4)=2/3×0.010mol/L÷40s=1.7×104 molL1s1,故B错误;
C. 分析表中数据可知,实验①和实验②只是浓度不同,即实验①和实验②是探究浓度对化学反应速率的影响;实验②和③只是温度不同,所以实验②和③是探究温度对化学反应速率的影响,故C正确;
D. 在其它条件都相同时,开始速率很小,过一会儿速率突然增大,说明反应生成了具有催化作用的物质,其中水没有这种作用,CO2释放出去了,所以可能起催化作用的是Mn2+,故D正确;
故选B。

【题目】利用化学原理可以对工厂排放的废水、废渣等进行有效检测与合理处理。某工厂对制革工业污泥中Cr(Ⅲ)回收与再利用工艺如下(硫酸浸取液中金属离子主要是Cr3+,其次是Fe3+、Al3+、Ca2+、Mg2+):
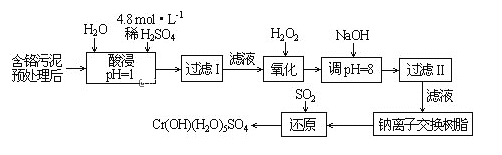
部分阳离子常温下以氢氧化物形式沉淀时溶液的pH见下表:
阳离子 | Fe3+ | Fe2+ | Mg2+ | Al3+ | Cu2+ | Cr3+ |
开始沉淀时的pH | 1.9 | 7.0 | —— | —— | 4.7 | —— |
沉淀完全时的pH | 3.2 | 9.0 | 11.1 | 8 | 6.7 | 9(>9溶解) |
(1)实验室用18.4 mol·L-1的浓硫酸配制250 mL 4.8 mol·L-1的硫酸溶液,所用的玻璃仪器除烧杯、玻璃棒和吸量管(一种能精确量取一定体积液体的仪器)外,还需______________________。
(2)酸浸时,为了提高浸取率可采取的措施有___________________________。(写出两个措施)
(3)加入H2O2的作用是_____________________________________。
(4)加入NaOH溶液使溶液呈碱性,Cr2O72―转化为CrO42―。滤液Ⅱ中阳离子主要有______;但溶液的pH不能超过8,其理由是_______________。
(5)钠离子交换树脂的反应原理为:Mn++nNaR→MRn+nNa+,利用钠离子交换树脂除去滤液Ⅱ中的金属阳离子是___________________。
(6)写出上述流程中用SO2进行还原的离子方程式___________________________。