题目内容
9.金属钛(Ti)因其硬度大、熔点高、常温时耐酸碱腐蚀而被广泛用作高新科技材料,被誉为“未来金属”.以钛铁矿(主要成分FeTiO3,钛酸亚铁)为主要原料冶炼金属钛同时获得副产品甲的工业生产流程如图1:
回答下列问题:
(1)钛铁矿和浓硫酸反应的产物之一是TiOSO4,反应中无气体生成.副产品甲阳离子是Fe2+.
(2)上述生产流程中加入铁屑的目的是防止Fe2+氧化.
(3)此时溶液Ⅰ中含有Fe2+、TiO2+和少量Mg2+等阳离子.常温下,其对应氢氧化物的Ksp如下表所示.
| 氢氧化物 | Fe(OH)2 | TiO(OH)2 | Mg(OH)2 |
| Ksp | 8.0×10-16 | 1.0×10-29 | 1.8×10-11 |
②若将含有Fe2+、TiO2+和Mg2+的溶液加水稀释,立即析出大量白色沉淀,写出该反应的离子方程式:TiO2++2H2O═H2TiO3↓+2H+.
(4)Mg还原TiCl4过程中必须在1070K的温度下进行,你认为还应该控制的反应条件是隔绝空气.
(5)在800~1000℃时电解TiO2也可制得海绵钛,装置如图2所示.图中b是电源的正极,阴极的电极反应式TiO2+4e-═Ti+2O2-.
分析 (1)加入过量铁屑后溶液中含有Fe2+离子;
(2)钛铁矿和浓硫酸反应的产物之一是TiOSO4,加入铁屑,可防止Fe2+氧化;
(3)①依据氢氧化镁的溶度积常数进行计算即可;
②已知TiO2+发生水解生成钛酸(H2TiO3)沉淀,根据元素守恒写出反应的离子方程式;
(4)为防止碳与氧气反应,应可绝空气加热;
(5)电解池的阳极发生失电子的氧化反应;电解池的阴极发生得电子的还原反应;电解TiO2也可制得海绵钛,变化是二氧化钛在阴极得到电子发生还原反应.
解答 解:(1)加入过量铁屑后溶液中含有Fe2+离子,故答案为:Fe2+;
(2)钛铁矿和浓硫酸反应的产物之一是TiOSO4,加入铁屑,可防止Fe2+氧化,故答案为:防止Fe2+氧化;
(3)①Ksp[Mg(OH)2]=c(Mg2+)×c2(OH-)=1.8×10-11,故c(OH-)=$\sqrt{\frac{1.8×1{0}^{-11}}{0.0018}}$=10-4,故c(H+)=$\frac{1{0}^{-14}}{1{0}^{-4}}$=10-10,故此时pH=10,故答案为:10;
②已知TiO2+发生水解生成钛酸(H2TiO3)沉淀和氢离子,其离子方程式为:TiO2++2H2O═H2TiO3↓+2H+,故答案为:TiO2++2H2O═H2TiO3↓+2H+; TiO2++2H2O═TiO(OH)2↓(或H2TiO3)+2H+;
(4)为防止碳与氧气反应,应可绝空气加热,故答案为:隔绝空气;
(5)电解池的阳极是氧离子发生失电子的氧化反应,导致氧气等气体的出现,所以电极反应式为:2O2-→O2↑+4e-,电解池的阴极发生得电子的还原反应,是二氧化钛电极本身得电子的过程,即TiO2+4e-→Ti+2O2-;电解池中,电解质里的阴离子O2-、Cl-均移向阳极,故答案为:正;TiO2+4e-→Ti+2O2-.
点评 本题考查物质的制备实验方案的设计,侧重于学生的分析能力和实验能力的考查,为高考常见题型,难度中等,注意把握实验的基本原理和物质的性质.

| A. | 可消除对大气的污染 | |
| B. | 可节约燃料 | |
| C. | 可缓解能源危机 | |
| D. | 此题中的CH4、CH3OH、NH3等为一级能源 |
| A. | 原子半径:Na<Mg<Al | B. | 热稳定性:HCl>HBr>HI | ||
| C. | 酸性强弱:H2SiO3<H2CO3<H2SO4 | D. | 熔点:SiO2>NaCl>CO2 |
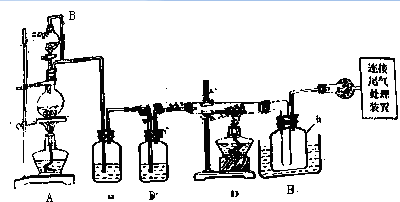
相关信息如下:
a.四氯化硅遇水极易水解;
b.硼、铝、铁、磷在高温下均能与氯气直接反应生成相应的氯化物;
c.有关物质的物理常数见表:
| 物质 | SiCl4 | BCl3 | AlCl3 | FeCl3 | PCl5 |
| 沸点/℃ | 57.7 | 12.8 | | 315 | |
| 熔点/℃ | -70.0 | -107.2 | | | |
| 升华温度/℃ | 180 | 300 | 162 |
请回答下列问题:
(1)装置A中g管的作用是平衡压强;装置C中的试剂是浓硫酸;装置E中的h 瓶需要冷却的理由是使SiCl4冷凝收集.
(2)装置E中h瓶收集到的粗产物可通过酒精(类似多次蒸馏)得到高纯度四氯化硅,精馏后的残留物中,除铁元素外可能还含有的杂质元素是Al、P(填写元素符号).
| A. | 原子半径 B>D>C | |
| B. | 原子序数 d>c>a | |
| C. | 离子半径 C>D>B | |
| D. | 原子结构的最外层电子数目 B>D>C |


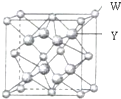 X、Y、Z、W四种元素分别位于周期表中三个紧邻的周期,且原子序数逐渐增大,X和Y的氢化物都比同族下一周期元素氢化物的沸点高,但在同周期中却不是最高的.Z是同周期元素中离子半径最小的元素.W原子的价电子层上有两个运动状态不同的电子.请回答下列问题:
X、Y、Z、W四种元素分别位于周期表中三个紧邻的周期,且原子序数逐渐增大,X和Y的氢化物都比同族下一周期元素氢化物的沸点高,但在同周期中却不是最高的.Z是同周期元素中离子半径最小的元素.W原子的价电子层上有两个运动状态不同的电子.请回答下列问题: