题目内容
1.下列说法正确的是( )| A. | 煤的气化和液化是高效、清洁地利用煤炭的重要途径 | |
| B. | 蚕丝的主要成分是纤维素 | |
| C. | pH小于7.0的降雨通常称为酸雨 | |
| D. | 含磷合成洗涤剂易于被细菌分解,故不会导致水污染 |
分析 A.煤的气化和液化能够减少大气污染物,提高煤的利用率;
B.依据蚕丝主要成分为蛋白质解答;
C.pH小于5.6的雨水为酸雨;
D.含磷废水导致水体富营养化;
解答 解:A.煤的气化和液化能够减少大气污染物,提高煤的利用率,是高效、清洁地利用煤炭的重要途径,故A正确;
B.蚕丝主要成分为蛋白质,故B错误;
C.酸雨中常溶有二氧化硫,被氧化为硫酸,导致酸雨的pH小于5.6,故C错误;
D.含磷合成洗涤剂中磷元素不能被细菌消除,则不能抑制水体富营养化的影响,故D错误;
故选:A.
点评 本题考查常见的生活环境的污染及治理,题目难度不大,注意常见环境污染的形成原因以及治理方法.

练习册系列答案
相关题目
11.由几种离子化合物组成的混合物,含有以下离子中的若干种:K+、Cl-、NH4+、Mg2+、Ba2+、CO32-、SO42-,将该混合物溶于水后得澄清溶液,现取3份各100mL的该溶液分别进行如下实验:
试回答下列问题:
(1)根据实验①对Cl-是否存在的判断是不能确定(填“一定存在”“一定不存在”或“不能确定”),根据实验①②③判断混合物中一定不存在的离子是Ba2+、Mg2+;
(2)试确定溶液中一定存在的阴离子及其物质的量浓度(可不填满):
(3)试确定K+存在(填是或否)存在.
| 实验序号 | 实验内容 | 实验结果 |
| ① | 加AgNO3溶液 | 有白色沉淀生成 |
| ② | 加足量NaOH溶液并加热 | 收集到气体1.12L(标准状况) |
| ③ | 加足量BaCl2溶液时,对所得沉淀进行洗涤、干燥、称量;再向沉淀中加入足量稀盐酸,然后干燥、称量 | 第一次称量读数为6.27g;第二次称量读数为2.33g |
(1)根据实验①对Cl-是否存在的判断是不能确定(填“一定存在”“一定不存在”或“不能确定”),根据实验①②③判断混合物中一定不存在的离子是Ba2+、Mg2+;
(2)试确定溶液中一定存在的阴离子及其物质的量浓度(可不填满):
| 阴离子符号 | 物质的量浓度/mol•L-1 |
9.下列离子方程式书写正确的是( )
| A. | MgSO4溶液与Ba(OH)2溶液反应:SO42-+Ba2+═BaSO4↓ | |
| B. | 向澄清石灰水中加入过量NaHCO3溶液:HCO3-+Ca2++OH-═CaCO3↓+H2O | |
| C. | 向Al2(SO4)3溶液中加入过量NaOH溶液:Al3++4OH-═AlO2-+2H2O | |
| D. | 向Ca(ClO2)溶液中通入少量SO2:Ca2++2ClO-+H2O+SO2═CaSO3↓+2HClO |
13.下列反应的离子方程式错误的是( )
| A. | NaNO2溶液中加入酸性KMnO4溶液:2MnO4-+5NO2-+6H+=2Mn2++5NO3-+3H2O | |
| B. | 碳酸氢铵溶液中加入足量氢氧化钡溶液:NH4++HCO3-+Ba2-+2OH-=BaCO3↓+NH3•H2O+H2O | |
| C. | Fe(NO3)3溶液中加入过量的HI溶液:2Fe3++2I-=2Fe2++I2 | |
| D. | 用惰性电极电解氯化钠溶液:2Cl-+2H2O$\frac{\underline{\;通电\;}}{\;}$Cl2↑+H2↑+2OH- |
10.某同学在实验报告中记录下列数据,其中正确的是( )
| A. | 用10mL量筒量取7.36mLNaOH 溶液 | |
| B. | 用托盘天平称取6.85g食盐 | |
| C. | 用标准的盐酸滴定未知浓度的NaOH 溶液,用去盐酸21.10mL | |
| D. | 用广泛pH 试纸测得某溶液pH 为5.5 |
11.关于常温下pH均为12的氨水和氢氧化钠溶液,下列说法正确的是( )
| A. | 氨水的物质的量浓度等于氢氧化钠溶液 | |
| B. | 将氨水体积稀释10倍,pH<11 | |
| C. | 等体积氨水和氢氧化钠溶液与足量氯化铁溶液反应,氨水产生的沉淀多 | |
| D. | 将等体积的氨水和氢氧化钠用稀盐酸完全中和,消耗盐酸的体积相同 |
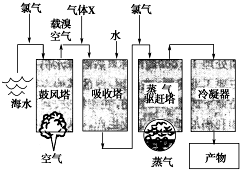 如图所示是以海水为原料,获得某产物的工艺流程图.已知在吸收塔中,溶液的pH显著减小.请回答下列问题:
如图所示是以海水为原料,获得某产物的工艺流程图.已知在吸收塔中,溶液的pH显著减小.请回答下列问题:
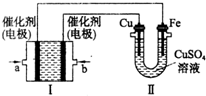 如图所示,装置1为甲烷燃料电池(电解质溶液为KOH溶液),通过装置II实现铁棒上镀铜.
如图所示,装置1为甲烷燃料电池(电解质溶液为KOH溶液),通过装置II实现铁棒上镀铜.