题目内容
9.某元素原子的原子核外有2个电子层,其最高正价与负价绝对值之差为2.该元素的气态氢化物与最高价氧化物对应的水化物发生反应的化学方程式为NH3+HNO3=NH4NO3.分析 最高正价与负价绝对值之差为2,又最高正价与负价绝对值之和为8,则最高正价为5,原子核外有2个电子层,应为N元素,以此解答该题.
解答 解:最高正价与负价绝对值之差为2,又最高正价与负价绝对值之和为8,则最高正价为5,原子核外有2个电子层,应为N元素,则氢化物为氨气,最高价的氧化物的水化物为硝酸,二者反应生成硝酸铵,方程式为NH3+HNO3=NH4NO3,
故答案为:NH3+HNO3=NH4NO3.
点评 本题以N元素为载体考查原子结构、元素性质,为高频考点,熟练掌握前36号元素原子结构,知道主族元素在周期表中位置的判断方法,题目难度不大.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
4.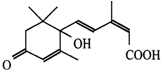 节日期间对大量盆栽鲜花施用了S-诱抗素制剂,以保证鲜花盛开.S-诱抗素的分子结构如图,下列关于该物质的说法正确的是( )
节日期间对大量盆栽鲜花施用了S-诱抗素制剂,以保证鲜花盛开.S-诱抗素的分子结构如图,下列关于该物质的说法正确的是( )
 节日期间对大量盆栽鲜花施用了S-诱抗素制剂,以保证鲜花盛开.S-诱抗素的分子结构如图,下列关于该物质的说法正确的是( )
节日期间对大量盆栽鲜花施用了S-诱抗素制剂,以保证鲜花盛开.S-诱抗素的分子结构如图,下列关于该物质的说法正确的是( )| A. | 1mol该物质与足量金属钠完全反应产生2mol H2 | |
| B. | 该物质能与FeCl3溶液发生显色反应 | |
| C. | 1mol该物质最多与5 mol氢气加成 | |
| D. | 既能发生加聚反应,又能发生酯化反应 |
14.下列说法正确的是( )
| A. | 1 mol/L的氯化钠溶液是指该溶液中含有1 molNaCl | |
| B. | 配制480ml0.5mol/L的CuSO4溶液,需40g胆矾(CuSO4•5H2O) | |
| C. | 0.5L2mol/LBaCl2溶液中,Ba2+和Cl-总数为3×6.02×1023 | |
| D. | 将58.5gNaCl溶于1L水中,所得溶液的物质的量浓度为1 mol/L |
1.某烯烃的结构简式为 ,甲、乙、丙、丁四位同学分别将其命名为:2甲基4乙基1戊烯、2异丁基1丁烯、5甲基3己烯、4甲基2乙基1戊烯.下列对四位同学的命名判断正确的是( )
,甲、乙、丙、丁四位同学分别将其命名为:2甲基4乙基1戊烯、2异丁基1丁烯、5甲基3己烯、4甲基2乙基1戊烯.下列对四位同学的命名判断正确的是( )
 ,甲、乙、丙、丁四位同学分别将其命名为:2甲基4乙基1戊烯、2异丁基1丁烯、5甲基3己烯、4甲基2乙基1戊烯.下列对四位同学的命名判断正确的是( )
,甲、乙、丙、丁四位同学分别将其命名为:2甲基4乙基1戊烯、2异丁基1丁烯、5甲基3己烯、4甲基2乙基1戊烯.下列对四位同学的命名判断正确的是( )| A. | 甲的命名主链选择是错误的 | B. | 乙的命名正确 | ||
| C. | 丙的命名主链选择是正确的 | D. | 丁的命名正确 |

