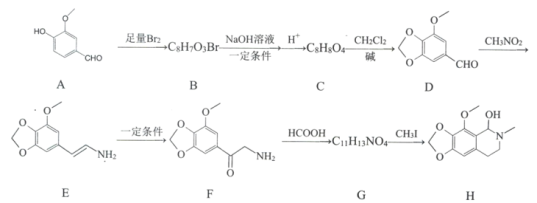
题目内容
【题目】根据相关知识回答下列问题
(1)①已知H2与O2反应生成lmolH2O(g)时放出241.8kJ的热量,请完成该反应的热化学方程式:2H2(g)+O2(g)-2H2O(g)△H=_____________kJ/mol;
②已知:C(石墨,s)=C(金刚石,s)△H>0 则稳定性:石墨_________金刚石(填“>”、“<“或“=”)。
(2)①25℃时,0.10mol/L的NaHCO3溶液呈碱性,原因是_________水解引起的(填“Na+”或“HCO3-”);该溶液中c(Na+)+c(HCO3-)_________0.2mol/L(填“>”、“<“或 “=”)
②常温下,0.0100mol/L盐酸的pH=________________;
③用0.0100mol/L盐酸滴定未知浓度的NaOH溶液,酚酞作指示剂,滴定终点时,溶液的颜色由浅红色变为__________(填“蓝色“或“无色”),且半分钟内保持不变。
(3)在某密闭容器中进行可逆反应:FeO(s)+CO(g)![]() Fe(s)+CO2(g)△H>0, 平衡常数表达式为K=
Fe(s)+CO2(g)△H>0, 平衡常数表达式为K=![]()
①反应达到平衡后,向容器中通入CO,化学平衡向__________方向移动(填“正反应”或“逆反应”);
②若升高温度,平衡常数K____________(填“增大”、“减少”“不变”);
③查阅资料得知1100℃时K=0.263。某时刻测得容器中c(CO2)=0.025mol/L,c(CO)=0.10mol/L,此时刻反应_____________平衡状态(填“达到”或“未达到”);其理由为:__________(写出必要的计算过程)。
【答案】-483.6 > HCO3- < 2 无色 正反应 增大 未达到 该时间的浓度商0.025/0.1与K值不相等
【解析】
(1)、①已知H2与O2反应生成1 mol H2O(g)时放出241.8 kJ的热量,生成2 mol H2O(g)时放出483.6 kJ的热量,反应的热化学方程式为2H2(g)+O2(g)-2H2O(g)△H= -483.6 kJ/mol;
②、已知: C(石墨,s)===C(金刚石,s)△H>0,由能量越低越稳定知,则稳定性石墨比金刚石强;
故答案为:-483.6;>;
(2)、①NaHCO3是强碱弱酸盐,水解呈碱性,是HCO3-水解导致,所以HCO3-浓度降低,c(Na+)+c(HCO3-)<0.2mol/L;
故答案为:
②、盐酸属于一元强酸,所以0.01mol/L的盐酸中的氢离子浓度为:0.01mol/L,pH=2;
③、酚酞遇酸显无色,遇碱变红,用0.0100 mol/L氢氧化钠溶液滴定未知浓度的盐酸,酚酞作指示剂,滴定终点时,溶液的颜色由无色变为浅红色,且半分钟内保持不变;
故答案为:HCO3-;<;2;无色;
(3)、①可逆反应FeO(s)+CO(g)![]() Fe(s)+CO2(g)△H>0达到平衡后,向容器中通入CO,反应物的浓度增大,化学平衡向正反应方向移动;
Fe(s)+CO2(g)△H>0达到平衡后,向容器中通入CO,反应物的浓度增大,化学平衡向正反应方向移动;
②、反应FeO(s)+CO(g)![]() Fe(s)+CO2(g)△H>0为吸热反应,若降低温度,平衡正向移动,平衡常数K增大;
Fe(s)+CO2(g)△H>0为吸热反应,若降低温度,平衡正向移动,平衡常数K增大;
③、在1 100℃时K=0.263。某时刻测得容器中c(CO2)=0.025mol/L,c(CO)=0.10mol/L,Q=![]() ,此时刻反应未达到平衡状态;
,此时刻反应未达到平衡状态;
故答案为:正反应;增大;未达到;该时间的浓度商与K值不相等。

【题目】绿矾(FeSO4·7H2O)外观为半透明蓝绿色单斜结晶或颗粒,无气味。受热能分解,且在空气中易被氧化。
I.医学上绿矾可用于补血剂甘氨酸亚铁[(NH2CH2COO)2Fe]颗粒的制备,有关物质性质如下:
甘氨酸(NH2CH2COOH) | 柠檬酸 | 甘氨酸亚铁 |
易溶于水,微溶于乙醇,两性化合物 | 易溶于水和乙醇,有强酸性和还原性 | 易溶于水,难溶于乙醇 |
(1)向绿矾溶液中,缓慢加入NH4HCO3溶液,边加边搅拌,反应结束后生成沉淀FeCO3。该反应的离子方程式为_______。
(2)制备(NH2CH2COO)2Fe:往FeCO3中加入甘氨酸(NH2CH2COOH)的水溶液,滴入柠檬酸溶液并加热。反应结束后过滤,滤液经蒸发结晶、过滤、洗涤、干燥得到产品。
①加入柠檬酸溶液一方面可调节溶液的pH促进FeCO3溶解,另一个作用是__。
②洗涤操作,选用的最佳洗涤试剂是_______(填序号)。
A.热水 B.乙醇 C.柠檬酸
II.绿矾晶体受热分解的反应为2FeSO4·7H2O![]() Fe2O3+SO2↑+SO3↑+14H2O,实验室用图I所示装置验证其分解产物。请回答下列问题:
Fe2O3+SO2↑+SO3↑+14H2O,实验室用图I所示装置验证其分解产物。请回答下列问题:
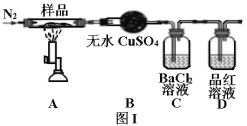
(1)加热前通入氮气的目的是_______。
(2)实验中观察到装置B现象为_______。
(3)C装置和D装置能否调换_______(填“能”或“否”)。
(4)样品完全分解后,残留物全部为红棕色固体,检验装置A中的残留物含有Fe2O3的方法是_______。
(5)该装置有个明显缺陷是_______。
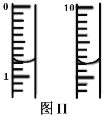
III.测定绿矾样品中铁元素的含量。
称取m g绿矾样品于锥形瓶中溶解后加稀H2SO4酸化,用 c mol·L1 KMnO4 溶液滴定至终点。耗KMnO4溶液体积如图II所示,(滴定时发生反应的离子方程式为:5Fe2++MnO4+8H+=5Fe3++Mn2++4H2O),该晶体中铁元素的质量分数为_______(用含m、c的式子表示)。