题目内容
3.一种黑色固体粉末可能含有铁、铜和氧三种元素中的两种或三种,将此固体溶于足量盐酸中,加入过量NaOH溶液,充分反应,过滤得到蓝色沉淀,沉淀经洗涤、干燥,再用酒精灯加热分解得到一种黑色粉末.则原黑色固体粉末的组成是CuO.分析 固体溶于足量盐酸中,加入过量NaOH溶液,充分反应,过滤得到蓝色沉淀,则组成中一定不含Fe元素,据此判断物质的元素组成.
解答 解:固体溶于足量盐酸中,加入过量NaOH溶液,充分反应,过滤得到蓝色沉淀即为氢氧化铜沉淀,则组成中一定不含Fe元素,据此得到物质的元素组成是Cu、O两种,原来的黑色固体是CuO.
故答案为:CuO.
点评 本题考查学生物质的元素组成知识,注意物质的性质以及伴随的现象的分析是推断的关键,难度中等.

练习册系列答案
 英语小英雄天天默写系列答案
英语小英雄天天默写系列答案 暑假作业安徽少年儿童出版社系列答案
暑假作业安徽少年儿童出版社系列答案
相关题目
14.一个集气瓶的质量为20.0g,在相同状况下,装满O2时质量为21.0g,装满A气体时为22.0g,则A气体的摩尔质量为( )
| A. | 16g/mol | B. | 32g/mol | C. | 64g/mol | D. | 128g/mol |
11.3molA和2.5molB混合于2L密闭容器中,发生的反应如下:3A(g)+B(g)?xC(g)+2D(g)5min后反应达到平衡,容器内压强变小,测得D的平均反应速率为0.1mol/(L•min),下列结论不正确的是( )
| A. | A的平均反应速率为0.15mol/(L•min) | |
| B. | 平衡时,A的转化率为20% | |
| C. | 平衡时,C的浓度为0.25mol/L | |
| D. | 容器内的起始压强和平衡压强之比为11:10 |
15.物质的量均为0.4mol的钠、镁、铝,分别与50mL 2.0mol/L盐酸反应,则生成的H2在同温同压下的体积比为( )
| A. | 1:1:1 | B. | 1:2:3 | C. | 4:1:1 | D. | 6:3:2 |
12.由硫酸钠、硫酸、硫酸铝组成的混合溶液的pH=1,并且c(SO${\;}_{4}^{2-}$)=0.8mol•L-1,c=(Na+)=0.3mol•L-1,则c(Al3+)为( )
| A. | 0.4mol•L-1 | B. | 0.43mol•L-1 | C. | 0.8mol•L-1 | D. | 1.2mol•L-1 |
13.下列各物质的分类、名称(或俗名)、化学式都正确的是( )
| A. | 金属氧化物、氧化铁、FeO | B. | 非金属氧化物、二氧化硫、SO2 | ||
| C. | 含氧酸、硫酸、H2SO3 | D. | 碱、纯碱、Na2CO3 |
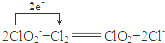 .
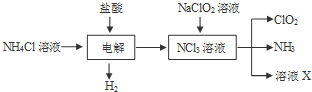
.
 ②CH3CH2CH(CH3)CH3 ③CH4 ④
②CH3CH2CH(CH3)CH3 ③CH4 ④ ⑤
⑤
 ⑦
⑦ ⑧
⑧

 的名称是3,4一二甲基辛烷.
的名称是3,4一二甲基辛烷. ,1mol该烃完全燃烧需消耗氧气18.5mol.
,1mol该烃完全燃烧需消耗氧气18.5mol.