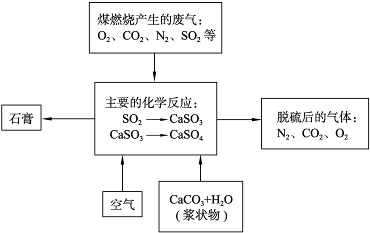
题目内容
(化学-化学与技术)
Ⅰ.金属铝的生产是以Al2O3为原料,在熔融状态下进行电解:2Al2O3
4Al+3O2↑
请回答下列问题:
(1)冰晶石(Na3AlF6)的作用是 .
(2)电解生成的金属铝是在熔融液的 (填“上层”或“下层”).
(3)电解时所消耗的电极是 (填“阳极”或“阴极”).
(4)铝是高耗能产品,废旧铝材的回收利用十分重要.在工业上,最能体现节能减排思想的是将回收铝做成 (填代号).
a.冰晶石 b.氧化铝 c.铝锭 d.硫酸铝
Ⅱ.钢铁工业对促进经济和社会发展起了重要作用.
(1)炼铁高炉分为五部分,铁矿石与高温煤气主要在 部分发生反应
(2)炼钢时,除磷的化学方程式为 ;加入硅、锰和铝的目的是 .
(3)不锈钢含有的Cr元素是在炼钢过程的氧吹 (填“前”或“后”)加入,原因是 .
(4)炼铁和炼钢生产中,尾气均含有的主要污染物是 .从环保和经济角度考虑,上述尾气经处理可用作 .
Ⅰ.金属铝的生产是以Al2O3为原料,在熔融状态下进行电解:2Al2O3
| ||
| 通电,Na3AlF6 |
请回答下列问题:
(1)冰晶石(Na3AlF6)的作用是
(2)电解生成的金属铝是在熔融液的
(3)电解时所消耗的电极是
(4)铝是高耗能产品,废旧铝材的回收利用十分重要.在工业上,最能体现节能减排思想的是将回收铝做成
a.冰晶石 b.氧化铝 c.铝锭 d.硫酸铝
Ⅱ.钢铁工业对促进经济和社会发展起了重要作用.
(1)炼铁高炉分为五部分,铁矿石与高温煤气主要在
(2)炼钢时,除磷的化学方程式为
(3)不锈钢含有的Cr元素是在炼钢过程的氧吹
(4)炼铁和炼钢生产中,尾气均含有的主要污染物是
分析:Ⅰ.(1)根据Al2O3的熔点很高,通过加冰晶石降低Al2O3的熔点;
(2)为方便分离,电解生成的Al在熔融液的下层;
(3)电解时阳极的碳棒被电解生成的氧气氧化;
(4)电解产生的铝要尽量以单质形式存在,且铝能够存在于自然界中;
Ⅱ.(1)铁矿石与高温煤气主要在炉身部分发生反应,在炉腰部分开始生成生铁和炉渣;
(2)炼钢时,利用P、FeO、CaO反应生成Ca3(PO4)2和Fe,炼钢时,加入硅、锰和铝主要是可以脱氧和调整钢的成分;
(3)因为Cr易被氧化,为防止Cr被氧化,不锈钢含有的Cr元素是在炼钢过程的氧吹后,若氧吹前加入Cr会形成炉渣被除去;
(4)炼铁和炼钢生产中,CO是主要的还原剂,故尾气均含有的主要污染物是CO,一氧化碳会引起中毒,故需对其进行处理等来解题.
(2)为方便分离,电解生成的Al在熔融液的下层;
(3)电解时阳极的碳棒被电解生成的氧气氧化;
(4)电解产生的铝要尽量以单质形式存在,且铝能够存在于自然界中;
Ⅱ.(1)铁矿石与高温煤气主要在炉身部分发生反应,在炉腰部分开始生成生铁和炉渣;
(2)炼钢时,利用P、FeO、CaO反应生成Ca3(PO4)2和Fe,炼钢时,加入硅、锰和铝主要是可以脱氧和调整钢的成分;
(3)因为Cr易被氧化,为防止Cr被氧化,不锈钢含有的Cr元素是在炼钢过程的氧吹后,若氧吹前加入Cr会形成炉渣被除去;
(4)炼铁和炼钢生产中,CO是主要的还原剂,故尾气均含有的主要污染物是CO,一氧化碳会引起中毒,故需对其进行处理等来解题.
解答:解:Ⅰ.(1)工业上采用电解Al2O3来制取Al,因Al2O3的熔点较高,为节约能源,因此常采用冰晶石来降低Al2O3的熔点,故答案为:降低Al2O3的熔化温度;
(2)铝液、电解质(Na3AlF6、氧化铝等混合物)都是在融熔状态下,也就是液态,铝液密度较大,所以在下层,故答案为:下层;
(3)电解的阴极、阳极材料均由石墨材料做,因阳极上O2-失电子发生氧化反应生成O2,阳极材料与该极上生成的O2反应被消耗,故答案为:阳极;
(4)电解产生的铝要尽量以单质形式存在,并且铝和氧气能生成一层致密的氧化物薄膜,保护内部铝继续被氧化,所以将回收铝做成铝锭最好.故选:c;
Ⅱ.(1)铁矿石与高温煤气主要在炉身部分发生反应,在炉腰部分开始生成生铁和炉渣,故答案为:炉身;
(2)炼钢时,利用P、FeO、CaO反应生成Ca3(PO4)2和Fe:2P+5FeO+3CaO
Ca3(PO4)2+5Fe,炼钢时,加入硅、锰和铝主要是为了脱氧和调整钢的成分,
故答案为:2P+5FeO+3CaO
Ca3(PO4)2+5Fe;脱氧和调整钢的成分;
(3)因为Cr易被氧化,为Cr被氧化,不锈钢含有的Cr元素是在炼钢过程的氧吹后,若氧吹前加入Cr会形成炉渣被除去.故答案为:后;避免Cr被氧化;
③炼铁和炼钢生产中,CO是主要的还原剂,故尾气均含有的主要污染物是CO,一氧化碳会引起中毒,故需对其进行尾气处理.一氧化碳是一种很好的还原剂同时还是一种燃料,
故答案为:CO;燃料.
(2)铝液、电解质(Na3AlF6、氧化铝等混合物)都是在融熔状态下,也就是液态,铝液密度较大,所以在下层,故答案为:下层;
(3)电解的阴极、阳极材料均由石墨材料做,因阳极上O2-失电子发生氧化反应生成O2,阳极材料与该极上生成的O2反应被消耗,故答案为:阳极;
(4)电解产生的铝要尽量以单质形式存在,并且铝和氧气能生成一层致密的氧化物薄膜,保护内部铝继续被氧化,所以将回收铝做成铝锭最好.故选:c;
Ⅱ.(1)铁矿石与高温煤气主要在炉身部分发生反应,在炉腰部分开始生成生铁和炉渣,故答案为:炉身;
(2)炼钢时,利用P、FeO、CaO反应生成Ca3(PO4)2和Fe:2P+5FeO+3CaO
| ||
故答案为:2P+5FeO+3CaO
| ||
(3)因为Cr易被氧化,为Cr被氧化,不锈钢含有的Cr元素是在炼钢过程的氧吹后,若氧吹前加入Cr会形成炉渣被除去.故答案为:后;避免Cr被氧化;
③炼铁和炼钢生产中,CO是主要的还原剂,故尾气均含有的主要污染物是CO,一氧化碳会引起中毒,故需对其进行尾气处理.一氧化碳是一种很好的还原剂同时还是一种燃料,
故答案为:CO;燃料.
点评:本题考查工业炼铝和铁,题目难度较大,易出错点为化学方程式的书写,注意把握反应的原理,注重相关基础知识的积累.

练习册系列答案
 新课标同步训练系列答案
新课标同步训练系列答案 一线名师口算应用题天天练一本全系列答案
一线名师口算应用题天天练一本全系列答案
相关题目
【化学-化学与技术】某强酸性工业废水中含有Fe2+、Fe3+、Cu2+,设计实验方案用沉淀法除去铁离子,得到较纯的Cu2+溶液.有关氢氧化物沉淀的pH如下表:
(1)从表中数据分析,为什么不能直接加NaOH将溶液pH调到9.7来除去Fe3+和Fe2+ .
(2)实际应用中则是先加一定量的次氯酸钠,然后再调节溶液pH.次氯酸钠的作用是 .
(3)pH应调节到什么范围 ,为什么 .
(4)调节pH适宜的试剂是
A.氢氧化钡B.碳酸镁,C、氧化铜、D、稀盐酸
理由 .
| 金属离子 | pH | |
| 开始沉淀 | 沉淀完全 | |
| Fe2+ | 6.3 | 9.7 |
| Cu2+ | 4.7 | 6.7 |
| Fe3+ | 1.9 | 3.2 |
(2)实际应用中则是先加一定量的次氯酸钠,然后再调节溶液pH.次氯酸钠的作用是
(3)pH应调节到什么范围
(4)调节pH适宜的试剂是
A.氢氧化钡B.碳酸镁,C、氧化铜、D、稀盐酸
理由
【化学--化学与技术】
海洋是一座巨大的宝藏,海洋资源的开发与利用具有广阔的前景.某地海水的pH在7.5~8.6之间,其中主要离子的含量如下表:
(1)电渗析法是近年发展起来的一种较好的海水淡化技术,其原理如图1.其中阴 (阳)离子交换膜只允许阴(阳)离子通过.
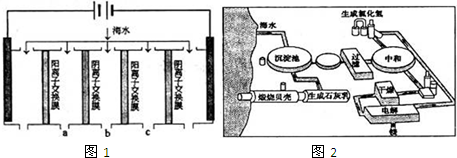
①阴极的电极反应式为 .
②电解一段时间,阴极区会产生水垢,其成分为CaCO3和Mg(OH)2,写出生成CaCO3的离子方程式 .
③淡水的出口为a、b、c中的 出口.
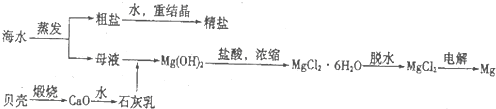
(2)如图2是工业上生产镁的流程.
①干燥步骤中将氯化镁的水合晶体转化为无水氯化镁的操作方法是 .
②整个生产流程中,循环使用的物质是 .
③有人认为:过滤步骤后,直接加热Mg(OH)2得MgO,再电解熔融的MgO制金属镁,这样可优化生产过程.你的观点是 (填“同意”或“不同意”);理由是 .
海洋是一座巨大的宝藏,海洋资源的开发与利用具有广阔的前景.某地海水的pH在7.5~8.6之间,其中主要离子的含量如下表:
| 成分 | Na+ | K+ | Ca2+ | Mg2+ | Cl- | SO 42- | HCO 3+ | 含量/mg?L-1 | 9360 | 83 | 200 | 1100 | 16000 | 1200 | 118 |

①阴极的电极反应式为
②电解一段时间,阴极区会产生水垢,其成分为CaCO3和Mg(OH)2,写出生成CaCO3的离子方程式
③淡水的出口为a、b、c中的
(2)如图2是工业上生产镁的流程.
①干燥步骤中将氯化镁的水合晶体转化为无水氯化镁的操作方法是
②整个生产流程中,循环使用的物质是
③有人认为:过滤步骤后,直接加热Mg(OH)2得MgO,再电解熔融的MgO制金属镁,这样可优化生产过程.你的观点是