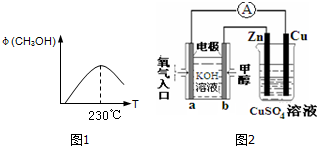
题目内容
18.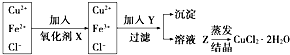 工业上制取纯净的CuCl2•2H2O的主要过程是:
工业上制取纯净的CuCl2•2H2O的主要过程是:①将粗氧化铜(含少量Fe)溶解于稀盐酸中.加热、过滤,调节滤液的pH为3;
②对①所得滤液按下列步骤进行操作:已知Cu2+、Fe2+在pH为4~5时不水解,而Fe3+却几乎完全水解而沉淀,请回答以下问题:
(1)X是Cl2(H2O2),其反应的离子方程式是Cl2+2Fe2+=2Fe3++2Cl-(2H++H2O2+2Fe2+=2Fe3++2H2O).
(2)Y物质应具备的条件是调节溶液的酸性,使PH为4~5,且不引入新杂质,生产中Y可选CuO或Cu(OH)2.
(3)溶液Z在蒸发结晶时应注意通入HCl气体(或加入盐酸),并不断搅拌且不能蒸干.
分析 工业上制取纯净的CuCl2•2H2O的主要过程:将粗氧化铜(含少量Fe)溶解于稀盐酸中,氧化铜和盐酸反应生成氯化铜,铁和盐酸反应生成氯化亚铁,过滤,滤液中含有亚铁离子、铜离子、氯离子,加入氧化剂将亚铁离子氧化成铁离子,然后加入Y调节溶液的pH,将铁离子转化成氢氧化铁沉淀除去,得到的溶液乙为氯化铜溶液,然后在持续通入HCl气体并不断搅拌条件下蒸发溶液乙获得氯化铜晶体.
(1)依据流程图可知实验目的是制备氯化铜晶体,需要除去亚铁离子,加入的X为氧化剂,但不能引入新的杂质;
(2)Y物质应调节溶液的酸性,调节溶液PH时铁离子全部沉淀,铜离子不能沉淀且不能引入新的杂质离子;
(3)氯化铜水溶液蒸发浓缩,铜离子水解,生成的氯化氢挥发,加热促进水解正向进行,得到氢氧化铜,实验需要在氯化氢气流中蒸发析出晶体.
解答 解:工业上制取纯净的CuCl2•2H2O的主要过程:将粗氧化铜(含少量Fe)溶解于稀盐酸中,氧化铜和盐酸反应生成氯化铜,铁和盐酸反应生成氯化亚铁,过滤,滤液中含有亚铁离子、铜离子、氯离子,加入氧化剂将亚铁离子氧化成铁离子,然后加入Y调节溶液的pH,将铁离子转化成氢氧化铁沉淀除去,得到的溶液乙为氯化铜溶液,然后在持续通入HCl气体并不断搅拌条件下蒸发溶液乙获得氯化铜晶体.
(1)依据流程图可知实验目的是制备氯化铜晶体,需要除去亚铁离子,加入的X为氧化剂,但不能引入新的杂质,通入氯气氧化亚铁离子为铁离子,反应的离子方程式为:Cl2+2Fe2+=2Fe3++2Cl-,若X是过氧化氢溶液,酸性溶液中也可以氧化亚铁离子为铁离子且不引入新的杂质,反应的离子方程式为:2H++H2O2+2Fe2+=2Fe3++2H2O;
故答案为:Cl2(H2O2);Cl2+2Fe2+=2Fe3++2Cl-(2H++H2O2+2Fe2+=2Fe3++2H2O);
(2)Y物质应调节溶液的酸性,调节溶液PH时铁离子全部沉淀,铜离子不能沉淀且不能引入新的杂质离子,实验需要加入和酸反应的固体物质CuO或Cu(OH)2,已知Cu2+、Fe2+在pH为4~5时不水解,而Fe3+几乎完全水解而沉淀,调节溶液PH值4--5,使铁离子完全沉淀;
故答案为:调节溶液的酸性,使PH为4~5,且不引入新杂质;CuO或Cu(OH)2 ;
(3)氯化铜水溶液蒸发浓缩,铜离子水解,CuCl2+H2O?Cu(OH)2+2HCl,生成的氯化氢挥发,加热促进水解正向进行,得到氢氧化铜,所以实验需要在氯化氢气流中蒸发,抑制水解反应进行,析出得到氯化铜晶体;
故答案为:通入HCl气体(或加入盐酸),并不断搅拌且不能蒸干.
点评 本题考查了物质制备实验方案的分析判断,实验操作过程的注意问题,除杂不能引入新的杂质是解题关键,题目难度中等.

 学业测评一课一测系列答案
学业测评一课一测系列答案| A. | 同温同压下,相同体积的物质,其物质的量一定相等 | |
| B. | 一氧化碳气体和氮气,若体积相等,则质量一定相等 | |
| C. | 1L一氧化碳气体一定比1L氧气的质量小 | |
| D. | 任何条件下,等物质的量的甲烷和一氧化碳所含的分子数一定相等 |
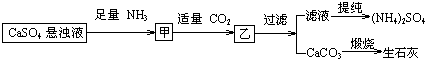
下列推断不合理的是( )
| A. | 通入CO2和NH3顺序可以颠倒 | |
| B. | 通入的NH3必须过量 | |
| C. | CO2可被循环使用 | |
| D. | 生成1mol(NH4)2SO4至少消耗2 mol NH3 |
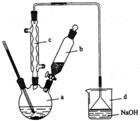 溴苯是一种化工原料,实验室合成溴苯的装置示意图及有关数据如下:
溴苯是一种化工原料,实验室合成溴苯的装置示意图及有关数据如下:| 苯 | 溴 | 溴苯 | |
| 密度/g•cm-3 | 0.88 | 3.10 | 1.50 |
| 沸点/℃ | 80 | 59 | 156 |
| 水中溶解度 | 微溶 | 微溶 | 微溶 |
(1)在a中加入15mL无水苯和少量铁屑.在b中小心加入4.0mL 液溴.向a中滴入几滴液溴,有白雾产生,是因为生成了HBr气体.继续滴加至液溴滴完.装置d中NaOH溶液的作用是吸收HBr和Br2.
(2)反应过程中,a外壁温度升高,为提高原料利用率,利用温度计控制温度,适宜的温度范围为(填序号)C.
A.>156℃B. 59℃-80℃C.<59℃
(3)液溴滴完后,经过下列步骤分离提纯:
①向a中加入10mL水,然后过滤除去未反应的铁屑;
②滤液依次用10mL水、8mL10%的NaOH溶液、10mL水洗涤.NaOH溶液洗涤的作用是除去未反应的Br2;
③向分离出的粗溴苯中加入少量的无水氯化钙,静置、过滤.加入氯化钙的目的是干燥或除去粗溴苯中的水.
(4)经过上述分离操作后,粗溴苯中还含有的主要杂质为苯,要进一步提纯,下列操作中必须的是C(填入正确选项前的字母).
A.重结晶 B.过滤 C.蒸馏 D.萃取.
Ⅰ.配制0.50mol/L NaOH溶液
(1)若实验中大约要使用245mL NaOH溶液,则至少需要称量NaOH固体5.0g.
(2)从下图中选择称量NaOH固体所需要的仪器(填序号)abe.
| 名称 | 托盘天平(带砝码) | 小烧杯 | 坩埚钳 | 玻璃棒 | 药匙 | 量筒 |
| 仪器 |  |  |  |  |  |  |
| 序号 | a | b | c | d | e | f |

(1)写出稀硫酸和稀氢氧化钠溶液反应表示中和热的热化学方程式(中和热数值57.3kJ/mol):NaOH(aq)+$\frac{1}{2}$H2SO4(aq)=$\frac{1}{2}$Na2SO4(aq)+H2O(l)△H=-57.3kJ/mol.
(2)取50mL NaOH溶液和30mL硫酸进行实验,实验数据如表.
①请填写下表中的空白:
| 实验次数 温度 | 起始温度t1/℃ | 终止温度t2/℃ | 平均温度差(t2-t1)/℃ | ||
| H2SO4 | NaOH | 平均值 | |||
| 1 | 26.2 | 26.0 | 26.1 | 30.1 | |
| 2 | 27.0 | 27.4 | 27.2 | 33.3 | |
| 3 | 25.9 | 25.9 | 25.9 | 29.8 | |
| 4 | 26.4 | 26.2 | 26.3 | 30.4 | |
③上述实验结果的数值与57.3kJ/mol有偏差,产生偏差的原因可能是(填字母)acd.
a.实验装置保温、隔热效果差
b.在量取NaOH溶液的体积时仰视读数
c.分多次把NaOH溶液倒入盛有稀硫酸的小烧杯中
d.用温度计测定NaOH溶液起始温度后直接测定H2SO4溶液的温度.

 对叔丁基苯酚
对叔丁基苯酚 工业用途广泛,可用于生产油溶性酚醛树脂、稳定剂和香料等.实验室以苯酚、叔丁基氯[(CH3)3CCl]等为原料制备对叔丁基苯酚.实验步骤如下:反应物和产物的相关数据列表如下:
工业用途广泛,可用于生产油溶性酚醛树脂、稳定剂和香料等.实验室以苯酚、叔丁基氯[(CH3)3CCl]等为原料制备对叔丁基苯酚.实验步骤如下:反应物和产物的相关数据列表如下: .该反应过于激烈,放出大量热,常使实验的产率降低,可能的原因是由于叔丁基氯挥发导致产率降低.
.该反应过于激烈,放出大量热,常使实验的产率降低,可能的原因是由于叔丁基氯挥发导致产率降低.