题目内容
【题目】如下各图烧杯中盛有海水,铁在其中被腐蚀由快到慢的顺序为 ( )
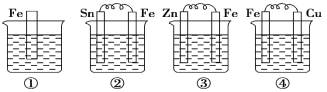
A.②①③④B.②④①③C.④②①③D.③②④①
【答案】C
【解析】
根据图知:①铁为活泼金属,可发生的是化学腐蚀;
②B为原电池装置,Fe较活泼,Fe为原电池的负极,发生氧化反应被腐蚀;
③Zn比Fe活泼,形成原电池反应,锌被氧化,铁作正极被保护;
④金属活动性Fe>Cu,铁作负极发生氧化反应被腐蚀,铜作正极;
①发生化学腐蚀,②发生电化学腐蚀,③锌比铁活泼,铁作原电池的正极而被保护,④发生电化学腐蚀,其中两个电极活泼些相差越大,铁被腐蚀速率越大,②④都是铁作负极被腐蚀,④中电极金属活泼性相差大所以Fe腐蚀速率④>②,电化学腐蚀的速率大于化学腐蚀的速率,腐蚀速率由快到慢的顺序为④>②>①>③,故合理选项是C。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案【题目】下表中对应关系正确的是( )
A | CH3CH3+Cl2 CH2=CH2+HCl→CH3CH2Cl | 均为取代反应 |
B | 由油脂得到甘油;由卤代烃制醇 | 均发生了水解反应 |
C | Cl2+2Br→2Cl+Br2;Zn+Cu2+→Zn2++Cu | 均为单质被还原的置换反应 |
D | 2Na2O2+2H2O→4NaOH+O2↑; 2F2+2H2O→4HF+ O2 | 均为水作还原剂的氧化还原反应 |
A.AB.BC.CD.D
【题目】下表为元素周期表的短周期部分。
a | |||||||
b | c | d | |||||
e | f | g | h |
请参照元素a-h在表中的位置,根据判断出的元素回答问题:
(1)h原子核外有 _____ 种不同伸展方向的电子云,最外层共有 _____ 种不同运动状态的电子。
(2)比较d、e元素常见离子的半径大小(用化学式表示)_______>__________;b、c 两元素非金属性较强的是(写元素符号)________,写出证明这一结论的一个化学方程式 ___________________ 。
(3)d、e元素形成的四原子化合物的电子式为___________;b、g元素形成的分子bg2为__________分子(填写“极性”或“非极性”)。
(4)上述元素可组成盐R:ca4f(gd 4)2和盐S:ca4agd4 ,相同条件下,0.1 mol/L 盐R中c(ca4+)________(填“等于”、“大于”或“小于”)0.1 mol/L 盐S中c(ca4+)。
(5)向盛有10mL1 mol/L盐S溶液的烧杯中滴加1 mol/L NaOH溶液至中性,则反应后各离子浓度由大到小的排列顺序是 __________________________________________ 。
(6)向盛有10mL 1 mol/L盐 R溶液的烧杯中滴加1 mol/L NaOH溶液32mL后,继续滴加至35mL写出此时段(32mL—35mL)间发生的离子方程式: _________________________ 。若在10mL 1 mol/L 盐R溶液的烧杯中加20mL1.2 mol/L Ba(OH)2溶液,充分反应后,溶液中产生沉淀的物质的量为__________mol。