��Ŀ����
(10��)���ǵ����Ϻ����ḻ��ԭ��Ԫ�أ������仯�����ڹ�ũҵ������������������Ҫ���á�
(1)25��ʱ��0.1mol/LNH4NO3��Һ��ˮ�ĵ���̶� ������ڡ��������ڡ���С�ڡ��� 0.1mol/L NaOH��Һ��ˮ�ĵ���̶ȡ�
(2)����0.1mol/L NaOH��Һ��0.2mol/LNH4NO3��Һ�������ϣ������Һ��
2c(NH4+)��c(NO3��)��������Һ������Ũ���ɴ�С��˳���� ��
(3)������ʱ��(N2H4)Ϊȼ�ϣ����������������������߷�Ӧ���ɵ�������̬ˮ�����ⶨ16g������������Ӧ�зų�284kJ��������
��÷�Ӧ���Ȼ�ѧ����ʽ�� ��
(4)��ͼ��1mol NO2��1mol CO��Ӧ����CO2��NO�����������仯ʾ��ͼ��
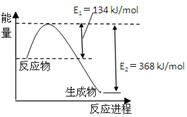
��֪��N2(g)��O2(g)��2NO(g) ��H����180kJ/mol
2NO (g)��O2(g)��N2(g)��2CO2(g) ��H����112.3kJ/mol
��Ӧ��2NO(g)��CO(g) N2(g)��2CO2(g)����H�� ��
N2(g)��2CO2(g)����H�� ��
��1������
��2��c(NO3��)��c(NH4+)��c(Na+)��c(OH��)��c(H+)
��3��2N2H4(g)��2NO2(g)��3N2(g)��2H2O (g) ��H����1136kJ/mol
��4����760.3kJ/mol
��������
���������(1)NH4+��ˮ�⣬�ٽ���ˮ�ĵ��룬��OH��������ˮ�ĵ��룬��ˣ�0.1mol/L
NH4NO3��Һ��ˮ�ĵ���̶ȴ���0.1mol/L NaOH��Һ��ˮ�ĵ���̶ȡ�
(2)����Һ��Ϻ�������Һ������ΪNaNO3��NH3��H2O��NH4NO3������Һ��2c(NH4+)��c(NO3��)����NH3��H2O�ĵ������NH4+��ˮ�⣬�����Һ�ʼ��ԣ��ʸ����ӵ�Ũ�ȴ�СΪ
c(NO3��)��c(NH4+)��c(Na+)��c(OH��)��c(H+)
(3)N2H4��NO2��Ӧ�Ļ�ѧ����ʽΪ��2N2H4+2NO2=3N2+4H2O����֪16g����0.5mol��������������Ӧ�зų�284kJ������������2mol�����巴Ӧ�ų�������Ϊx���ɵõ�ʽ��
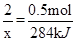 x=1136kJ�����ԣ����Ȼ�ѧ����ʽΪ2N2H4(g)��2NO2(g)��3N2(g)��2H2O (g) ��H����1136kJ/mol
x=1136kJ�����ԣ����Ȼ�ѧ����ʽΪ2N2H4(g)��2NO2(g)��3N2(g)��2H2O (g) ��H����1136kJ/mol
(4)���ݸ�˹���ɣ��ɼ�����ô˷�Ӧ����H=��760.3kJ/mol
���㣺�������Һ���Ȼ�ѧ
������������Ҫ�����˵������Һ������Ũ�ȴ�С�ıȽϡ��Ȼ�ѧ����ʽ����д�����ݡ�
������Һ������Ũ�ȴ�С�ıȽϣ����ֿ�����Һ�����ӵ�ˮ������룻
�����Ȼ�ѧ����ʽ����д��Ӧע������ͨ��ѧ����ʽ��д������ͬʱ��Ӧ�ȵļ�����ҪӦ�ø�˹���ɡ�

(10��)���ǵ����Ϻ����ḻ��һ��Ԫ�أ������仯�����ڹ�ũҵ������������������Ҫ���á���ش��������⣺
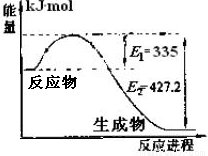
��1����ͼ��N2��H2��Ӧ����2molNH3�����������仯ʾ��ͼ�������ÿ����1molNH3�ų�����Ϊ ��
��2���ڹ̶�������ܱ������У��������»�ѧ��Ӧ��N2(g)+3H2(g)2NH3(g)���仯ѧƽ�ⳣ��K��t�Ĺ�ϵ���±���
| t/K | 298 | 398 | 498 | ���� |
| K/(mol��L��1)��2 | 4.1��106 | K1 | K2 | ���� |
������������⣺
���ԱȽ�K1��K2�Ĵ�С��K1 K2����д��>����=����<����
�����и�������Ϊ�жϸ÷�Ӧ�ﵽ��ѧƽ��״̬�����ݵ��� ���������ĸ����
����A��������N2��H2��NH3��Ũ��֮��Ϊ1��3��2����B��2v(N2)(��)= v(H2)(��)
����C��������ѹǿ���ֲ��� ����D�����������ܶȱ��ֲ���
��3�������£�N2H6Cl2����һ����Ҫ�Ļ���ԭ�ϣ��������ӻ����������ˮ����Һ�����ԣ�ˮ��ԭ����NH4Cl���ơ�
����д�������µ�һ��ˮ�ⷴӦ�����ӷ���ʽ ��
����������ˮ��Һ������Ũ�ȵĹ�ϵ��ʾ��ȷ���� ������ţ���
����A��c(Cl��)>c(N2H62+)>c(H+)>c(OH��)
����B��c(Cl��)>c([N2H5��H2O]+)>c(OH��)>c(H+)
����C��2c(N2H62+)+c([N2H5��H2O]+)+ c(H+) =c(Cl��)+c(OH��)
����D��c(N2H62+) > c(Cl��)> c(H+)>c(OH��)
(10��)���ǵ����Ϻ����ḻ��һ��Ԫ�أ������仯�����ڹ�ũҵ������������������Ҫ���á���ش��������⣺
��1����ͼ��N2��H2��Ӧ����2molNH3�����������仯ʾ��ͼ�������ÿ����1molNH3�ų�����Ϊ ��
��2���ڹ̶�������ܱ������У��������»�ѧ��Ӧ��N2(g)+3H2(g) 2NH3(g)���仯ѧƽ�ⳣ��K��t�Ĺ�ϵ���±���
2NH3(g)���仯ѧƽ�ⳣ��K��t�Ĺ�ϵ���±���
|
t/K |
298 |
398 |
498 |
���� |
|
K/(mol��L��1)��2 |
4.1��106 |
K1 |
K2 |
���� |
������������⣺
���ԱȽ�K1��K2�Ĵ�С��K1 K2����д��>����=����<����
�����и�������Ϊ�жϸ÷�Ӧ�ﵽ��ѧƽ��״̬�����ݵ��� ���������ĸ����
����A��������N2��H2��NH3��Ũ��֮��Ϊ1��3��2����B��2v(N2)(��)= v(H2)(��)
����C��������ѹǿ���ֲ��� ����D�����������ܶȱ��ֲ���
��3�������£�N2H6Cl2����һ����Ҫ�Ļ���ԭ�ϣ��������ӻ����������ˮ����Һ�����ԣ�ˮ��ԭ����NH4Cl���ơ�
����д�������µ�һ��ˮ�ⷴӦ�����ӷ���ʽ ��
����������ˮ��Һ������Ũ�ȵĹ�ϵ��ʾ��ȷ���� ������ţ���
����A��c(Cl��)>c(N2H62+)>c(H+)>c(OH��)
����B��c(Cl��)>c([N2H5��H2O]+)>c(OH��)>c(H+)
����C��2c(N2H62+)+c([N2H5��H2O]+)+ c(H+) = c(Cl��)+c(OH��)
����D��c(N2H62+) > c(Cl��)> c(H+) >c(OH��)