��Ŀ����
����Ŀ����һ��������Mg��Al�����Ͷ�뵽200mLϡ�����У�����ȫ���ܽ����������Һ�еμ�NaOH��Һ�����������ɳ��������ʵ��������NaOH��Һ�������ϵ��ͼ��ʾ��������˵������ȷ���ǣ� ��
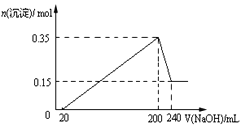
A. ���ɵ������ڱ�״���µ����Ϊ11.2L
B. ���20mLNaOH��Һ�����к�����ϡ����
C. NaOH��Һ���ʵ���Ũ��Ϊ5mol��L-1
D. Mg��Al��������Ϊ9g
���𰸡�A
��������A������ͼ��Al(OH)3�����ʵ���Ϊ(0.35��0.15)mol=0.2mol��������þ�����ʵ���Ϊ0.15mol������Ԫ���غ㣬�Ͻ���n(Al)=0.2mol��n(Mg)=0.15mol���Ͻ������ᷴӦ���������������ʵ���Ϊ(0.2��3��0.15��2)/2mol=0.45mol�����������Ϊ0.45��22.4L=10.08L����A˵������B��0��20mLû�г��������������ķ�Ӧ��H����OH��=H2O��������20mLNaOH��Һ�����к�����ϡ���ᣬ��B˵����ȷ��C��200��240mL�����ķ�ӦAl(OH)3��OH��=AlO2����2H2O������NaOH�����ʵ���Ϊ0.2mol����c(NaOH)=0.2/40��10��3mol��L��1=5mol��L��1����C˵����ȷ��D������Aѡ��������Ͻ������Ϊ(0.2��27��0.15��24)g=9g����D˵����ȷ��

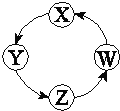
����Ŀ�����и��������У��������ͼʾ������ͨ����������һ��ת�������ֻ��
��� | X | Y | Z | W |
|
�� | Cu | CuSO4 | Cu��OH��2 | CuO | |
�� | Na | NaOH | Na2CO3 | NaCl | |
�� | Cl2 | Ca��ClO��2 | HClO | HCl | |
�� | Fe | FeCl3 | FeCl2 | Fe��OH��2 |
A. �٢ڢ� B. �٢ۢ� C. �ڢ� D. �٢ڢ�
����Ŀ����ͼ��Ԫ�����ڱ���һ���� 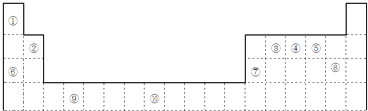
��1��Ԫ�آ�Ĵ���������Ϊ����
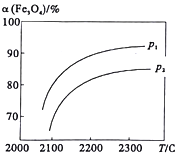
��2��������¶Ƚӽ�373Kʱ������M=m/n�ⶨ�ݵ���̬�⻯�����Է���������������ֲⶨ���������ֵ�ߣ���ԭ������
��3��ijЩ��ͬ��Ԫ�ص�����Ҳ��һ���������ԣ����ϱ���Ԫ�آ���Ԫ�آڵ��������������Ƶ����ʣ�д��Ԫ�آڵ�����������NaOH��Һ��Ӧ�����ӷ���ʽ��
��4��������������Ԫ�صĵ�һ�����ĵ��������ݣ���λ��kJmol��1�����ش�������⣺
Ԫ�ش��� | I1 | I2 | I3 | I4 |
Q | 2080 | 4000 | 6100 | 9400 |
R | 500 | 4600 | 6900 | 9500 |
S | 740 | 1500 | 7700 | 10500 |
T | 580 | 1800 | 2700 | 11600 |
U | 420 | 3100 | 4400 | 5900 |
�������ڱ��У�����ܴ���ͬһ������� �� ����Ԫ�ش��ţ�
��TԪ������������s������p������d������ds���ȣ���Ԫ�أ���TΪ�ڶ�����Ԫ�أ�Z�ǵ�������Ԫ����ԭ�Ӱ뾶��С������Ԫ�أ���T��Z�γɵĻ�������Ӽ���Ϊ ��