题目内容
已知有关物质及离子的氧化性强弱顺序为:浓硫酸>Fe3+>H+.现将30g铁粉(过量)与44.0mL浓硫酸在加热条件下充分反应,共收集到11.2L(标准状况)气体,其质量为19.6g.试计算:(1)浓硫酸的物质的量浓度;(2)反应后剩余铁粉的质量.
答案:
解析:
解析:
|
6H2SO4(浓)+2Fe Fe2(SO4)3+Fe=3FeSO4 Fe+H2SO4=FeSO4+H2↑ n(SO2)=0.3mol,n(H2)=0.2mol 则n1(H2SO4)=0.6mol,n1(Fe)=0.2mol,n1[Fe2(SO4)3]=0.1mol n2(Fe)=0.2mol,n3(H2SO4)=0.2mol,n3(Fe)=0.1mol c(H2SO4)= m(Fe)=30g-(0.2+0.2+0.1)mol×56g·mol-1=2g |

练习册系列答案
相关题目
 Fe2(SO4)3+3SO2↑+6H2O
Fe2(SO4)3+3SO2↑+6H2O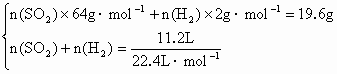
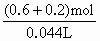 ≈18.2mol·L-1
≈18.2mol·L-1