题目内容
【题目】固定容积为2L的密闭容器中发生反应xA(g)+yB(g)![]() zC(g),图I表示t℃时容器中各物质的量随时间的变化关系,图II表示平衡常数K随温度变化的关系。结合图像判断,下列结论正确的是
zC(g),图I表示t℃时容器中各物质的量随时间的变化关系,图II表示平衡常数K随温度变化的关系。结合图像判断,下列结论正确的是
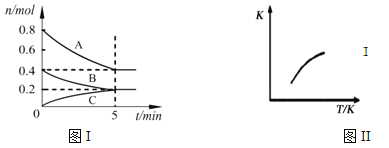
A. 该反应可表示为:2A(g)+B(g)![]() C(g)ΔH﹤0
C(g)ΔH﹤0
B. t℃时该反应的平衡常数K=6.25
C. 当容器中气体密度不再变化时,该反应达到平衡状态
D. t℃,在第6 min时再向体系中充入0.4 mol C,再次达到平衡时C的体积分数大于0.25
【答案】D
【解析】试题分析:A.由图Ⅰ可知,该反应为2A(g)+B(g)![]() C(g),由图Ⅱ可知,当温度升高时,平衡常数K增大,证明反应正向移动,因此该反应正向为吸热反应,即ΔH>0,A错误;B.t℃时物质A的平衡浓度为0.2mol/L,B的平衡浓度为0.1mol/L,C的平衡浓度为0.1mol/L,故该反应的平衡常数K=0.1/(0.22×0.1)=25,B错误;C.根据质量守恒可知,反应前后,气体的质量保持不变,由于容器的体积不变,因此反应前后气体的密度不发生变化,故当容器中气体的密度不再发生变化时,不能证明该反应达到平衡状态,C错误;D.t℃,达到平衡状态时,C的体积分数为0.25,在第6 min时再向体系中充入0.4 mol C,平衡逆向移动,但是0.4molC不能完全转化为A和B,因此再次达到平衡时C的体积分数大于0.25,D正确。答案选D。
C(g),由图Ⅱ可知,当温度升高时,平衡常数K增大,证明反应正向移动,因此该反应正向为吸热反应,即ΔH>0,A错误;B.t℃时物质A的平衡浓度为0.2mol/L,B的平衡浓度为0.1mol/L,C的平衡浓度为0.1mol/L,故该反应的平衡常数K=0.1/(0.22×0.1)=25,B错误;C.根据质量守恒可知,反应前后,气体的质量保持不变,由于容器的体积不变,因此反应前后气体的密度不发生变化,故当容器中气体的密度不再发生变化时,不能证明该反应达到平衡状态,C错误;D.t℃,达到平衡状态时,C的体积分数为0.25,在第6 min时再向体系中充入0.4 mol C,平衡逆向移动,但是0.4molC不能完全转化为A和B,因此再次达到平衡时C的体积分数大于0.25,D正确。答案选D。

 中考利剑中考试卷汇编系列答案
中考利剑中考试卷汇编系列答案【题目】现用氯化铜晶体(CuCl2·2H2O,含氯化亚铁杂质)制取纯净的CuCl2·2H2O。先将其制成水溶液,后按如图步骤进行提纯:

已知Cu2+、Fe3+和Fe2+的氢氧化物开始沉淀和沉淀完全时的pH见下表
金属离子 | Fe3+ | Fe2+ | Cu2+ |
氢氧化物开始沉淀时的pH | 1.9 | 7.0 | 4.7 |
氢氧化物沉淀完全时的pH | 3.2 | 9.0 | 6.7 |
请回答下列问题:
(1)现有氧化剂NaClO、H2O2、KMnO4,X加哪种好,为什么?________________________________,该反应的离子方程式为_________________________________。
(2)溶液II中除Cu2+外,还有______金属离子,检验试剂为______________。物质Y不能为下列的________________________。
a.CuO b.Cu(OH)2 c.CuCO3 d.Cu2(OH)2CO3 e.CaO f.NaOH
(3)常温下,除去CuCl2溶液中的Fe2+,加入氧化剂X,使Fe2+氧化为Fe3+,然后加入物质Y至溶液pH=4,此时c(Fe3+)=_________mol/L,[已知Fe(OH)3的Ksp=4×10-38]
(4)若在空气中加热固体CuCl2·2H2O,可水解生成Cu(OH)Cl,写出相关的化学方程式_______________________________________。