题目内容
【题目】Ⅰ.查阅资料,乙二酸(HOOC-COOH,可简写为H2C2O4)俗称草酸,易溶于水,属于二元中强酸(为弱电解质),且酸性强于碳酸。
(1)已知高锰酸钾能氧化草酸.反应如下(部分产物和生成物未写):MnO![]() +H2C2O4→Mn2++CO2↑。若把该反应设计成一原电池,则正极的电极反应式为___。
+H2C2O4→Mn2++CO2↑。若把该反应设计成一原电池,则正极的电极反应式为___。
(2)某同学将2.52g草酸晶体(H2C2O42H2O)加入到100mL0.2molL-1的NaOH溶液中充分反应,测得反应后溶液呈酸性,则其中含碳元素的粒子中物质的量浓度最小的微粒化学式为___。
Ⅱ.某化学兴趣小组在一次实验探究中发现,向草酸溶液中逐滴加入酸性高锰酸钾溶液时,发现反应速率变化如图所示,小组成员探究t1~t2时间内速率变快的主要原因,为此“异常”现象展开讨论,猜想造成这种现象的最可能原因有两种。
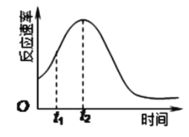
猜想Ⅰ:此反应过程放热,温度升高,反应速率加快;
猜想Ⅱ:……。
(3)猜想Ⅱ可能是:___。
(4)基于猜想Ⅱ成立,设计方案进行实验,请完成以下实验记录表内容。
试管A | 试管B | |
加入试剂 | 2mL0.1mol/LH2C2O4溶液、1mL0.05mol/L酸性KMnO4 | 2mL0.1mol/LH2C2O4溶液、1mL0.05mol/L酸性KMnO4,少量___固体(填物质名称) |
实验现象 (褪色时间) | 褪色时间10min | 褪色时间___10min (选填“<”“>”或“=”) |
结论 | 猜想Ⅱ正确 | |
Ⅲ.为了测定含有H2C2O4·2H2O、KHC2O4和K2SO4的试样中各物质的质量分数,进行如下实验:
①称取6.0g试样,加水溶解,配成250mL试样溶液。
②用酸式滴定管量取25.00mL试样溶液放入锥形瓶中,并加入2~3滴酚酞试液,用0.2500mol/LNaOH溶液滴定,消耗NaOH溶液20.00mL。
③再取25.00mL试样溶液放入另一锥形瓶中,用0.1000mol/L的酸性高锰酸钾溶液滴定,消耗高锰酸钾溶液16.00mL。
回答下列问题:
(5)步骤③中判断滴定终点的方法是___。
(6)步骤②中量取试样溶液时,酸式滴定管用蒸馏水洗过后没有润洗,则测得H2C2O4·2H2O的质量分数___。(填“偏大”、“偏小”或“无影响”)
【答案】MnO![]() +5e-+8H+=Mn2++4H2O H2C2O4 生成的Mn2+对该反应有催化作用,加快反应速率 硫酸锰 < 溶液由无色变为浅红色(或紫色、紫红色),且半分钟内不褪色 偏小
+5e-+8H+=Mn2++4H2O H2C2O4 生成的Mn2+对该反应有催化作用,加快反应速率 硫酸锰 < 溶液由无色变为浅红色(或紫色、紫红色),且半分钟内不褪色 偏小
【解析】
(1)原电池的正极发生还原反应,高锰酸根离子中锰元素的化合价降低,发生还原反应,由此分析解答;
(2)H2C2O42H2O物质的量0.02mol,与 NaOH恰好完全反应生成草酸氢钠,混合后溶液呈酸性,说明草酸氢根离子电离程度大于水解程度,结合电荷守恒判断离子浓度大小;
Ⅱ.(3)猜想II是认为生成的Mn2+在反应中起到催化剂的作用,故应补充MnSO4,通过测量溶液褪色的时间来验证猜想;
(4)要通过对比实验来验证猜想Ⅱ,则实验B和实验A的加入试剂除了MnSO4固体不同,其他均应相同,据此分析;
Ⅲ.(5)原溶液无色,KMnO4为紫红色,当溶液中的H2C2O4和KHC2O4反应完全时,溶液呈紫红色且半分钟颜色不变;
(6)步骤②中量取试样溶液时,酸式滴定管用蒸馏水洗过后没有润洗,导致标准溶液氢氧化钠的体积增大,据此回答问题。
(1)已知高锰酸钾能氧化草酸反应如下:MnO![]() +H2C2O4→Mn2++CO2↑。若把该反应设计成一原电池,根据原电池原理,正极发生还原反应,化合价降低,则正极的电极反应式为MnO
+H2C2O4→Mn2++CO2↑。若把该反应设计成一原电池,根据原电池原理,正极发生还原反应,化合价降低,则正极的电极反应式为MnO![]() +5e-+8H+=Mn2++4H2O。
+5e-+8H+=Mn2++4H2O。
(2)某同学将2.52g草酸晶体(H2C2O42H2O)即0.02mol,加入到100mL0.2molL-1的NaOH溶液中充分反应,二者恰好完全反应生成草酸氢钠,混合后溶液呈酸性,说明草酸氢根离子电离程度大于水解程度,水电离生成氢离子,结合电荷守恒判断离子浓度大小为Na+>HC2O4->H+>C2O4->H2C2O4>OH-,则其中含碳元素的粒子中物质的量浓度最小的微粒化学式为H2C2O4。
Ⅱ.(3)根据反应速率的影响因素知,可能是反应生成的Mn2+起了催化作用,从而使反应速率加快;。
(4)猜想Ⅱ成立,即Mn2+在反应中起到催化剂的作用,从而加快了反应速率,所以和设计方案进行实验,要进行一组对比实验,一支试管A中仅仅2mL0.1mol/L H2C2O4溶液、1mL 0.05mol/L 酸性KMnO4,另外一支试管B中加入2mL0.1mol/L H2C2O4溶液、1mL 0.05mol/L 酸性KMnO4,少量MnSO4(s),根据溶液褪色的快慢来判断Mn2+在反应中是否起到催化剂的作用,若猜想Ⅱ成立,褪色时间小于10min。
试管A | 试管B | |
加入试剂 | 2mL0.1mol/LH2C2O4溶液、1mL0.05mol/L酸性KMnO4 | 2mL0.1mol/LH2C2O4溶液、1mL0.05mol/L酸性KMnO4,少量硫酸锰固体 |
实验现象 (褪色时间) | 褪色时间10min | 褪色时间<10min |
结论 | ||
Ⅲ. (5)原溶液无色,而KMnO4为紫红色,所以当溶液中的H2C2O4和KHC2O4反应完全时,滴入最后一滴溶液呈紫红色且半分钟颜色不变,滴定到终点。
(6)步骤②中量取试样溶液时,酸式滴定管用蒸馏水洗过后没有润洗,导致标准溶液氢氧化钠的体积增大,测定KHC2O4的含量增大,草酸含量减小。

 名校课堂系列答案
名校课堂系列答案【题目】如表陈述Ⅰ、Ⅱ均正确,且两者在反应原理上相似的是( )
选项 | 陈述Ⅰ | 陈述Ⅱ |
A | 将 |
|
B |
|
|
C | 玻璃试剂瓶可用于盛放氢氟酸 | 石英坩埚不能用于熔化NaOH |
D |
|
|
A.AB.BC.CD.D