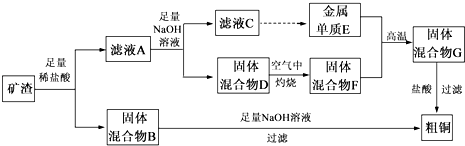
题目内容
【题目】某温度下纯水中的c(H+)=2×10﹣7molL﹣1 , 则此时水中的c(OH﹣)=;若温度不变,滴入稀盐酸,使c(H+)=5×10﹣4molL﹣1 , 则此时溶液中由水电离产生的c(OH﹣)= .
【答案】2×10﹣7mol?L﹣1;8×10﹣11mol/L
【解析】解:某温度下纯水中的c(H+)=2×10﹣7molL﹣1 , 则此时水中的c(OH﹣)=2×10﹣7molL﹣1 , 该温度下Kw=2×10﹣7molL﹣1×2×10﹣7molL﹣1=4×10﹣14(molL﹣1)2 , 温度不变,滴入稀盐酸,使c(H+)=5×10﹣4molL﹣1 , 则此时溶液中由水电离产生的c(OH﹣)= ![]() =8×10﹣11mol/L,故答案为:2×10﹣7molL﹣1;8×10﹣11mol/L.
=8×10﹣11mol/L,故答案为:2×10﹣7molL﹣1;8×10﹣11mol/L.
水电离的c(OH﹣)=c(H+),温度不变,Kw不变,滴入稀盐酸,使c(H+)=5×10﹣4molL﹣1 , 则c(OH﹣)= ![]() ,以此计算.
,以此计算.

【题目】另一化学研究性学习小组在实验室条件下用以硫酸铜溶液为电解液,用电解的方法实现了粗铜的提纯,并对阳极泥和电解液中金属进行回收和含量测定.已知粗铜中含有少量的锌、铁、银、金等金属和少量矿物杂质(与酸不反应).
(1)步骤一:电解精制:电解时,粗铜应与电源的极相连.阴极上的电极反应式为 .
(2)步骤二:电解完成后,该小组同学按以下流程对电解液进行处理: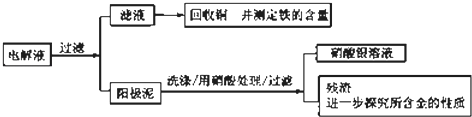
①阳极泥的综合利用:稀硝酸处理阳极泥得到硝酸银稀溶液,请写出该步反应的离子方程式: , 残渣含有极少量的黄金,如何回收金,他们查阅了有关资料,了解到了一些有关金的信息:
序号 | 反应 | 平衡常数 |
1 | Au+6HNO3Au(NO3)3+3NO2↑+3H2O | <<1 |
2 | Au3++4Cl﹣AuCl4- | >>1 |
请根据以上信息简要解释溶解阳极泥不用王水的原因 .
②滤液含量的测定:以下是该小组探究滤液的一个实验流程.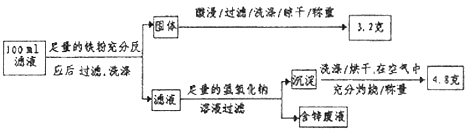
则100mL滤液中Cu2+的浓度为 molL﹣1 , Fe2+的浓度为 molL﹣1 .