题目内容
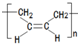
12.高分子材料E和含扑热息痛高分子药物的合成流程如图所示:
已知:I.含扑热息痛高分子药物的结构为:
 .
.II.RCOOH$\stackrel{SOCl_{2}}{→}$

III.
 $\stackrel{Na溶液}{→}$RCOONa+R′-NH2
$\stackrel{Na溶液}{→}$RCOONa+R′-NH2试回答下列问题:
(1)①的反应类型为加成反应,G的分子式为C4H5OCl.
(2)若1mol
 可转化为1mol A和1mol B,且A与FeCl3溶液作用显紫色,写出A的稀溶液与过量浓溴水发生反应的化学方程式
可转化为1mol A和1mol B,且A与FeCl3溶液作用显紫色,写出A的稀溶液与过量浓溴水发生反应的化学方程式 .
.(3)反应②为加成反应,则B的结构简式为
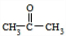 ;扑热息痛的结构简式为
;扑热息痛的结构简式为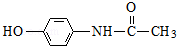 .
.(4)写出含扑热息痛高分子药物与足量氢氧化钠溶液发生反应的化学方程式
 .
.(5)D蒸气密度是相同状态下甲烷密度的6.25倍,D中各元素的质量分数分别为碳60%,氢8%,氧32%.D有多种同分异构体,其中属于链状酯类,且能发生银镜反应的同分异构体有11种(考虑顺反异构).
分析 苯和丙烯在氯化铝存在条件下发生加成反应生成异丙苯,异丙苯被氧化生成A和B,B和氢氰酸发生加成反应生成 ,则B为
,则B为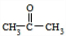 ,1mol
,1mol  可转化为1mol A和1mol B,且A与FeCl3溶液作用显紫色,说明A中含有酚羟基,根据碳原子守恒知A是
可转化为1mol A和1mol B,且A与FeCl3溶液作用显紫色,说明A中含有酚羟基,根据碳原子守恒知A是 .
. 与甲醇/水、H+发生反应生成D,D蒸气密度是相同状态下甲烷密度的6.25倍,则D的相对分子质量是16×6.25=100,D中各元素的质量分数分别为碳60%,氢8%,氧32%,则碳、氢、氧原子个数比=$\frac{60%}{12}$:$\frac{8%}{1}$:$\frac{32%}{16}$=5:8:2,则D的分子式为C5H8O2,D的不饱和度为$\frac{2×5+2-8}{2}$=2,所以D中含有碳碳双键,且含有酯基,则D的结构简式为CH2=C(CH3)COOCH3;D发生加聚反应生成E为
与甲醇/水、H+发生反应生成D,D蒸气密度是相同状态下甲烷密度的6.25倍,则D的相对分子质量是16×6.25=100,D中各元素的质量分数分别为碳60%,氢8%,氧32%,则碳、氢、氧原子个数比=$\frac{60%}{12}$:$\frac{8%}{1}$:$\frac{32%}{16}$=5:8:2,则D的分子式为C5H8O2,D的不饱和度为$\frac{2×5+2-8}{2}$=2,所以D中含有碳碳双键,且含有酯基,则D的结构简式为CH2=C(CH3)COOCH3;D发生加聚反应生成E为 .由反应信息II可知
.由反应信息II可知 和SOCl2发生取代反应生成G为CH2=C(CH3)COCl,G与扑热息痛反应生成H,H反应生成
和SOCl2发生取代反应生成G为CH2=C(CH3)COCl,G与扑热息痛反应生成H,H反应生成 ,则H为
,则H为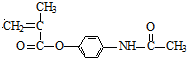 ,扑热息痛的结构简式为
,扑热息痛的结构简式为 ,据此解答.
,据此解答.
解答 解:苯和丙烯在氯化铝存在条件下发生加成反应生成异丙苯,异丙苯被氧化生成A和B,B和氢氰酸发生加成反应生成 ,则B为
,则B为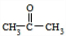 ,1mol
,1mol  可转化为1mol A和1mol B,且A与FeCl3溶液作用显紫色,说明A中含有酚羟基,根据碳原子守恒知A是
可转化为1mol A和1mol B,且A与FeCl3溶液作用显紫色,说明A中含有酚羟基,根据碳原子守恒知A是 .
. 与甲醇/水、H+发生反应生成D,D蒸气密度是相同状态下甲烷密度的6.25倍,则D的相对分子质量是16×6.25=100,D中各元素的质量分数分别为碳60%,氢8%,氧32%,则碳、氢、氧原子个数比=$\frac{60%}{12}$:$\frac{8%}{1}$:$\frac{32%}{16}$=5:8:2,则D的分子式为C5H8O2,D的不饱和度为$\frac{2×5+2-8}{2}$=2,所以D中含有碳碳双键,且含有酯基,则D的结构简式为CH2=C(CH3)COOCH3;D发生加聚反应生成E为
与甲醇/水、H+发生反应生成D,D蒸气密度是相同状态下甲烷密度的6.25倍,则D的相对分子质量是16×6.25=100,D中各元素的质量分数分别为碳60%,氢8%,氧32%,则碳、氢、氧原子个数比=$\frac{60%}{12}$:$\frac{8%}{1}$:$\frac{32%}{16}$=5:8:2,则D的分子式为C5H8O2,D的不饱和度为$\frac{2×5+2-8}{2}$=2,所以D中含有碳碳双键,且含有酯基,则D的结构简式为CH2=C(CH3)COOCH3;D发生加聚反应生成E为 .由反应信息II可知
.由反应信息II可知 和SOCl2发生取代反应生成G为CH2=C(CH3)COCl,G与扑热息痛反应生成H,H反应生成
和SOCl2发生取代反应生成G为CH2=C(CH3)COCl,G与扑热息痛反应生成H,H反应生成 ,则H为
,则H为 ,扑热息痛的结构简式为
,扑热息痛的结构简式为 .
.
(1)反应①是苯和丙烯发生加成反应,G为CH2=C(CH3)COCl,分子式为 C4H5OCl,
故答案为:加成反应;C4H5OCl;
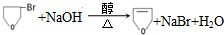
(2)A是 ,苯酚和过量浓溴水发生取代反应,反应方程式为:
,苯酚和过量浓溴水发生取代反应,反应方程式为: ,
,
故答案为: ;
;
(3)由上述分析可知,B的结构简式为: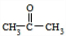 ,扑热息痛的结构简式为:
,扑热息痛的结构简式为: ,
,
故答案为: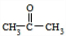 ;
; ;
;
(4)含扑热息痛高分子药物与足量氢氧化钠溶液发生反应的化学方程式为: ,
,
故答案为: ;
;
(5)D为CH2=C(CH3)COOCH3,其同分异构体属于链状酯类,且能发生银镜反应,应为甲酸形成的酯基,则该物质是甲酸某酯,形成酯的醇碳链结构为:C=C-C-C-、C-C=C-C-(有顺反)、C-C-C=C-(有顺反)、C=C(C)-C-、C=C-C(C)-、C-C(C)=C-、C-C=C(C)-(有顺反)、C=C(C-C)-,所以D的符合条件的同分异构体有11种,
故答案为:11.
点评 本题考查有机物的推断与合成,根据转化中有机物的结构、反应条件与给予的信息采用正逆相结合的方法进行分析,熟练掌握官能团的性质与转化,难点是同分异构体种类的判断,注意有碳链异构、官能团异构和顺反异构,难度较大.

 口算题天天练系列答案
口算题天天练系列答案
为解决有关问题,兴趣小组同学查得有关物质沉淀的pH数据如下:
| 物质 | pH (开始沉淀) | pH(完全沉淀) |
| Fe(OH)3 | 1.9 | 3.2 |
| Fe(OH)2 | 7.0 | 9.0 |
| Cu(OH)2 | 4.7 | 6.7 |
(2)操作X包括蒸发浓缩、冷却结晶、过滤和洗涤等.CuCl2•3H2O加热灼烧的最终产物的化学式是过滤洗涤CuO.
| A. | 碳酸钙与盐酸反应:CO32-+2H+═CO2↑+H2O | |
| B. | 铁溶于氯化铁溶液:Fe3++Fe═2Fe2+ | |
| C. | 氢氧化钠溶液与硫酸反应:H++OH-═H2O | |
| D. | 钠与水反应:Na+2H2O═Na++2OH-+H2↑ |
| 阳离子 | H+、NH4+、Mg2+、Ba2+、Al3+ |
| 阴离子 | OH-、Cl-、HCO3-、NO3-、SO42- |
②B溶液与其它四种溶液反应,均能产生沉淀;
③向C溶液中逐滴加入B溶液,有白色沉淀生成,当B溶液过量时,沉淀完全溶解.
回答下列问题:
(1)写出下列物质的化学式:AH2SO4、BBa(OH)2.
(2)D、E两种物质中必有一种是NH4HCO3,写出将少量该物质的稀溶液滴加到0,1mol/L B溶液中反应的离子方程式Ba2++2OH-+NH4++HCO3-=BaCO3↓+NH3H2O+H2O.
(3)用铝粉可除去废水中的NO3-.在pH为10.7左右的溶液中,加入铝粉除去NO3-,同时产生物质的量之比为1﹕1的氨气和氮气,该反应的还原产物是NH3、N2,除去0.1mol NO3-,要消耗铝5.4g,其对应离子方程式为6Al+3NO3-+3OH-=6AlO2-+NH3↑+N2↑.
①乙烯可用于催熟果实
②纤维素可用于造纸
③液氨可用作致冷剂
④二氧化硫可用于漂白纸浆.
| A. | 只有①② | B. | 只有③④ | C. | 只有②③④ | D. | ①②③④都正确 |
| A. | 胶体粒子能透过滤纸,但不能透过半透膜 | |
| B. | Fe(OH)3胶体粒子具有较大的表面积,具有吸附性,能吸附阳离子,故在电场作用下会产生电泳现象 | |
| C. | 向Fe(OH)3胶体中逐滴滴入稀硫酸,会先出现红褐色沉淀然后沉淀消失的现象 | |
| D. | 只有胶体粒子能作布朗运动 |

 同学的实验设计方案是否严密?请说明理由:________________________________。
同学的实验设计方案是否严密?请说明理由:________________________________。
 .
. .
. .
.
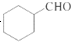 的合成路线流程图(无机试剂任用).合成路线流程图示例如下:
的合成路线流程图(无机试剂任用).合成路线流程图示例如下: