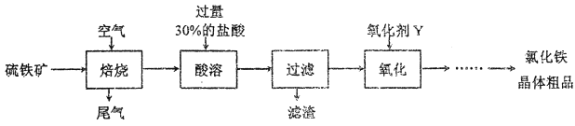
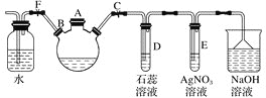
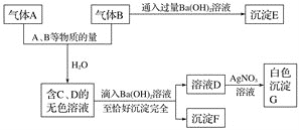
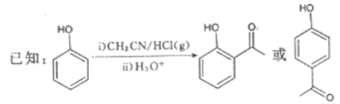
题目内容
【题目】从海水中可以获得淡水、食盐,并可提取镁和溴等物质.
(1)从海水中提取镁的流程如下图所示:

反应①的离子方程式为_______________________________________________
反应②的化学方程式为_______________________________________________
(2)海水提取溴流程:

该流程中涉及发生反应的离子方程式:①_______________________②________________________
该流程中溴元素被氧化又被还原又被氧化的目的是:_______________________________________
【答案】Mg(OH)2+2H+=Mg2++2H2OMgCl2(熔融)![]() Mg+Cl2↑Cl2+2Br-=2Cl-+Br2Br2+SO2+2H2O = 4H++2Br-+SO42-富集溴元素
Mg+Cl2↑Cl2+2Br-=2Cl-+Br2Br2+SO2+2H2O = 4H++2Br-+SO42-富集溴元素
【解析】
(1)因反应①是Mg(OH)2与盐酸反应生成氯化镁:Mg(OH)2+2HCl=MgCl2+2H2O,离子方程式为Mg(OH)2+2H+═Mg2++2H2O;反应②是电解熔融MgCl2:MgCl2(熔融)![]() Mg+Cl2↑,故答案为:Mg(OH)2+2H+═Mg2++2H2O;MgCl2(熔融)
Mg+Cl2↑,故答案为:Mg(OH)2+2H+═Mg2++2H2O;MgCl2(熔融)![]() Mg+Cl2↑;
Mg+Cl2↑;
(2)海水提取溴过程中,在海水中通入氯气氧化溴离子,置换出溴,然后通过热空气吹出溴,吹出来的溴用二氧化硫还原,得到溴化氢溶液,最后再用氯气氧化得到溴单质。涉及的反应有:①Cl2+2Br-=2Cl-+Br2、②Br2+SO2+2H2O = 4H++2Br-+SO42-,该流程中溴元素被氧化又被还原又被氧化的目的是富集溴元素,故答案为:Cl2+2Br-=2Cl-+Br2;Br2+SO2+2H2O = 4H++2Br-+SO42-;富集溴元素。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案【题目】(1)向K2Cr2O7的水溶液中加入Ba(NO3)2溶液,产生难溶性黄色沉淀BaCrO4,说明K2Cr2O7的水溶液中存在如下平衡:__________________________________________,产生沉淀后溶液PH变________.已知:在水溶液中K2Cr2O7为橙红色,K2CrO4为黄色,往上述溶液中加入氢氧化钠溶液呈_________色;向已加入氢氧化钠的溶液中,再加入过量硫酸溶液呈___________色;此实验现象,符合勒夏特列原理:如果改变维持化学平衡的条件(浓度、压力和温度),平衡就会向着_________这种改变的方向移动。
(2)在KMnO4与H2C2O4反应中,可通过测定_________________来测定该反应的速率;写出酸性条件下KMnO4与H2C2O4(弱酸)反应的离子反应方程式:____________________________;此反应开始反应缓慢,随后反应迅速加快,其原因是______(填字母)
A.KMnO4溶液中的H+起催化作用 B.生成的CO2逸出,使生成物浓度降低
C.反应中,生成的Mn2+起催化作用 D.在酸性条件下KMnO4的氧化性增强
(3)为探讨化学反应速率的影响因素,设计的实验方案如下表。(已知 I2+2S2O32-===S4O62-+2I-,其中Na2S2O3溶液均足量)
实验 序号 | 体积V/mL | 时间/s | |||
Na2S2O3溶液 | 淀粉溶液 | 碘水 | 水 | ||
① | 10.0 | 2.0 | 4.0 | 0.0 | t1 |
② | 8.0 | 2.0 | 4.0 | 2.0 | t2 |
③ | 6.0 | <>2.0 | 4.0 | Vx | t3 |
①该实验进行的目的是_____________淀粉溶液的作用是____________。
②表中Vx=_______mL,比较t1、t2、t3大小____________,试推测该实验结论: ____________
【题目】二氧化锰是制造锌锰干电池的基本材料,工业上以软锰矿、菱锰矿为原料来制备。某软锰矿主要成分为MnO2,还含有Si(16.27%)、Fe(5.86%)、Al(3.42%)、Zn(2.68%)和Cu(0.86%)等元素的化合物,其处理流程图如下:

化合物 | Al(OH)3 | Fe(OH)2 | Fe(OH)3 |
Ksp近似值 | 10-31 | 10-16 | 10-38 |
(1)硫酸亚铁在酸性条件下将MnO2还原为MnSO4,酸浸时发生的主要反应的化学方程式为_____________________________________________________________。
(2)“氨水、搅拌”,其中“搅拌”不仅能加快反应速率,还能___________________________;滤渣A的成分是Fe(OH)3、Al(OH)3,加入氨水需调节pH至少达到____________,恰好能使Fe3+、Al3+沉淀完全(当c≤10-5 mol·L-1时,认为该离子沉淀完全)。
(3)滤渣B的成分是______________。
(4)碱性锌锰电池中,MnO2参与的电极反应式为__________________________________。
(5)MnO2也可在MnSO4-H2SO4-H2O为体系的电解液中电解获得,其阳极反应式为___________________________________。
(6)工业上采用间接氧化还原滴定法测定MnO2纯度,其操作过程如下:准确称量0.920 0 g该样品,与足量酸性KI溶液充分反应后,配制成100 mL溶液。取其中10.00 mL,恰好与25.00 mL 0.080 0 mol·L-1Na2S2O3溶液反应(I2+2S2O![]() ===2I-+S4O
===2I-+S4O![]() )。计算可得该样品纯度为_____________。(保留一位小数)
)。计算可得该样品纯度为_____________。(保留一位小数)