题目内容
以黄铁矿为原料制硫酸产生的硫酸渣中含Fe2O3、SiO2、Al2O3、MgO等。实验室模拟工业以硫酸渣制备铁红(Fe2O3),过程如下:

(1)硫酸渣的成分中属于两性氧化物的是 , 写出酸溶过程Fe2O3与稀硫酸反应的离子反应方程式: ;
(2)生产过程中,为了确保铁红的纯度,氧化过程需要调节溶液的pH的范围是_________;(部分阳离子以氢氧化物形式沉淀时溶液的pH见下表)
|
沉淀物 |
Fe(OH)3 |
Al(OH)3 |
Fe(OH)2 |
Mg(OH)2 |
|
开始沉淀 |
2.7 |
3.8 |
7.5 |
9.4 |
|
完全沉淀 |
3.2 |
5.2 |
9.7 |
12.4 |
(3)滤渣A的主要成分为 ,滤液B可以回收的物质有______________________;
(4)简述洗涤过程的实验操作 ;
(5)已知硫酸渣质量为w kg,假设铁红制备过程中,铁元素损耗25%,最终得到铁红的质量为m kg,则原来硫酸渣中铁元素质量分数为 (用最简分数表达式表示)。
(已知相对原子质量:O 16 S 32 Fe 56 )
(16分)(1) Al2O3 2分 Fe2O3 + 6H+ ==2Fe3+ + 3H2O 2分
(2)3.2—3.8 2分 (3) SiO2 2分 Na2SO4 Al2(SO4)3 MgSO4 3分,每个1分
(4) 沿玻璃棒向漏斗(过滤器)的沉淀加蒸馏水至淹没沉淀,静置使液体自然流出,重复操作数次(3次)至沉淀洗涤干净。 2分
(5)14m/15w 2分
【解析】
试题分析:(1)Al2O3为两性氧化物,硫酸渣的成分中属于两性氧化物的是Al2O3;Fe2O3与稀硫酸反应生成Fe2(SO4)3和H2O,离子方程式为:Fe2O3 + 6H+ ==2Fe3+ + 3H2O。
(2)根据题目所给表中数据可以看出,Fe3+完全沉淀而其它离子还未沉淀的pH范围是:3.2—3.8。
(3)硫酸渣中SiO2不与H2SO4反应,所以滤渣A的主要成分为SiO2;加入NaOH调节pH后,Fe3+转化为Fe(OH)3沉淀,其它离子仍为硫酸盐,所以滤液B可以回收的物质有: Na2SO4 Al2(SO4)3 MgSO4
(4)用蒸馏水洗涤沉淀的方法为:沿玻璃棒向漏斗(过滤器)的沉淀加蒸馏水至淹没沉淀,静置使液体自然流出,重复操作数次(3次)至沉淀洗涤干净。
(5)m kg铁红含铁元素:m×112/160, 原来硫酸渣中铁元素质量分数为: m×112/160÷(1-25%)÷w=14m/15w。
考点:本题考查化学工艺流程的分析、离子方程式的书写、沉淀的洗涤、质量分数的计算。

 名校课堂系列答案
名校课堂系列答案 (2011?镇江一模)以黄铁矿为原料制硫酸产生的废渣中含Fe2O3、SiO2、Al2O3、CaO、MgO等.现以此废渣制备铁红(Fe2O3)的过程如下.此浓度时,部分阳离子以氢氧化物形式沉淀时溶液的pH由见表.
(2011?镇江一模)以黄铁矿为原料制硫酸产生的废渣中含Fe2O3、SiO2、Al2O3、CaO、MgO等.现以此废渣制备铁红(Fe2O3)的过程如下.此浓度时,部分阳离子以氢氧化物形式沉淀时溶液的pH由见表.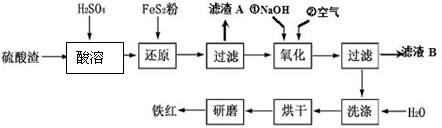
 和
和
