题目内容
4.CaO2难溶于水,溶于酸生成过氧化氢,在医药上用作杀菌剂、防腐剂等.Ⅰ.CaO2制备原理:Ca(OH)2(s)+H2O2(aq)═CaO2(s)+2H2O(l);△H<0
不同浓度的H2O2对反应生成CaO2产率的影响如表:
| H2O2/% | 5 | 10 | 15 | 20 | 25 | 30 |
| CaO2/% | 62.40 | 63.10 | 63.20 | 64.54 | 62.42 | 60.40 |
Ⅱ.过氧化钙中常含有CaO杂质,实验室可按以下步骤测定CaO2含量.
步骤1:准确称取0.04~0.05g过氧化钙样品,置于250mL的锥形瓶中;
步骤2:分别加入30mL蒸馏水和2mL盐酸(3mol•L-1),振荡使之溶解;
步骤3:向锥形瓶中加入5mL KI溶液(100g•L-1);
步骤4:用硫代硫酸钠标准溶液滴定,至溶液呈浅黄色,然后加入指示剂淀粉溶液,用硫代硫酸钠标准溶液继续滴定,直至溶液的蓝色恰好消失且半分钟内颜色不变,记录数据;
步骤5:平行测定3次,计算试样中CaO2的质量分数.滴定时发生的反应为2Na2S2O3+I2═Na2S4O6+2NaI.
(2)过氧化钙溶解时选用盐酸而不选用硫酸溶液的原因是生成微溶的CaSO4覆盖在过氧化钙表面,使结果不准确.
(3)加入KI溶液后发生反应的离子方程式为H2O2+2I-+2H+═I2+2H2O.
(4)请补充完整实验步骤4中的内容:加入指示剂淀粉溶液;直至溶液的蓝色恰好消失且半分钟内颜色不变.
分析 本题探究的是利用CaO2制备过氧化氢,并利用滴定原理测定CaO2含的纯度,涉及滴定操作的实验流程设计,包括指示剂选择淀粉溶液和滴定终点的判断,制备过氧化氢时要关注它的不稳定性,因此要控制温度,另外还有反应原理的分析,相对较易;
(1)根据双氧水不稳定及该反应为放热反应分析;
(2)硫酸钙为微溶物,生成的硫酸钙会覆盖在过氧化钙表明,乙烯测定结果;
(3)双氧水在酸性条件下能够氧化碘离子,据此写出反应的离子方程式;
(4)淀粉遇到碘单质显示蓝色,需要加入淀粉作指示剂;当恰好反应时淀粉消失,溶液变为无色,据此判断滴定终点.
解答 解:(1)根据反应Ca(OH)2(s)+H2O2(aq)=CaO2+2H2O(l)△H<0可知,该反应为放热反应,双氧水浓度升高,则反应速率加快,反应放出的热量增大,导致双氧水分解,所以H2O2浓度大于20%后CaO2产率反而减小,
故答案为:H2O2浓度高,反应速率快,反应放热使体系温度迅速升高,加快H2O2发生分解;
(2)若用稀硫酸,稀硫酸与钙离子反应生成微溶物硫酸钙覆盖在过氧化钙表面,使结果不准确,所以不能用稀硫酸,可以用稀盐酸,故答案为:生成微溶的CaSO4覆盖在过氧化钙表面,使结果不准确;
(3)加入KI溶液后,双氧水将碘离子氧化成碘单质,反应的离子方程式为:H2O2+2I-+2H+═I2+2H2O,故答案为:H2O2+2I-+2H+═I2+2H2O;
(4)碘单质遇到淀粉会显示蓝色,当用硫代硫酸钠标准溶液滴定,至溶液呈浅黄色,然后加入淀粉作滴定的指示剂,用硫代硫酸钠标准溶液继续滴定;滴定结束前溶液为蓝色,反应结束后溶液为无色,则滴定终点的现象为:溶液的蓝色恰好消失且半分钟内颜色不变,故答案为:加入指示剂淀粉溶液;直至溶液的蓝色恰好消失且半分钟内颜色不变.
点评 本题考查了探究物质组成、含量的方法,题目难度中等,明确实验原理为解答关键,注意掌握化学实验基本操作方法,明确中和滴定原理,能够正确选用指示剂用和滴定终点,试题培养了学生的分析能力及化学实验能力.

| A. | 钢铁插入水中,水下部分比空气与水交界处更容易腐蚀 | |
| B. | 钢铁在海水中比在河水中更易腐蚀,主要是由于海水中有大量电解质 | |
| C. | 钢铁设备上连接铜块可以防止钢铁腐蚀 | |
| D. | 钢铁设备与外加直流电源的正极相连可以防止钢铁腐蚀 |
| A. | 在Na2CO3和NaHCO3溶液中离子种类相同 | |
| B. | 在溶质物质的量浓度和体积相等的Na2A和NaHA溶液中,阴离子总数相等 | |
| C. | 在NaHCO3溶液中一定有:c(Na+)+c(H+)═c(HCO3-)+c(OH-)+2 c(CO32-) | |
| D. | 在Na2CO3溶液中一定有:c(OH-)═c(H+)+c(HCO3-)+2c(H2CO3) |

可能用到的有关数据如下:
| 相对分子质量 | 密度/(g•cm-3) | 沸点/℃ | 溶解性 | |
| 环己醇 | 100 | 0.961 8 | 161 | 微溶于水 |
| 环己烯 | 82 | 0.810 2 | 83 | 难溶于水 |
分离提纯:反应粗产物倒入分液漏斗中分别用少量5%碳酸钠溶液和水洗涤,分离后加入无水氯化钙颗粒,静置一段时间后弃去氯化钙.最终通过蒸馏得到纯净环己烯10g.
回答下列问题:
(1)装置b的名称是直形冷凝器.
(2)加入碎瓷片的作用是防止暴沸;如果加热一段时间后发现忘记加瓷片,应该采取的正确操作是B(填正确答案标号).
A.立即补加 B.冷却后补加
C.不需补加 D.重新配料
(3)本实验中最容易产生的副产物的结构简式为
 .
.(4)分液漏斗在使用前须清洗干净并检漏;在本实验分离过程中,产物应该从分液漏斗的上口倒出(填“上口倒出”或“下口放出”).
(5)分离提纯过程中加入无水氯化钙的目的是干燥.
(6)在环己烯粗产物蒸馏过程中,不可能用到的仪器有CD(填正确答案标号).
A.圆底烧瓶 B.温度计 C.吸滤瓶
D.球形冷凝管 E.接收器
(7)本实验所得到的环己烯产率是C(填正确答案标号).
A.41% B.50%C.61% D.70%
| A. | 利用油脂在碱性条件下的水解反应,可以生产甘油和肥皂 | |
| B. | 油脂在小肠内受酶的催化作用而水解,生成的高级脂肪酸和甘油作为人体营养成分为肠壁所吸收,同时提供人体活动所需要的能量 | |
| C. | 油脂中的碳链为碳碳单键时,主要是高沸点的动物脂肪 | |
| D. | 油脂是人体所需的基本营养物质之一,应尽量多食用油脂类物质 |
| A. | NA个N2分子和NA个CO2原子个数比为1:1 | |
| B. | 1 mol H2O的质量与NA个H2O质量的总和几乎相等 | |
| C. | 1mol H2所含的原子数为NA | |
| D. | 1mol H2SO4中所含的粒子数目一定是NA |
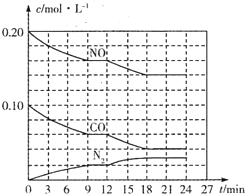 为有效控制雾霾,各地积极采取措施改善大气质量.有效控制空气中氮氧化物、碳氧化物和硫氧化物显得尤为重要.在汽车排气管内安装催化转化器,可将汽车尾气中主要污染物转化为无毒的大气循环物质.
为有效控制雾霾,各地积极采取措施改善大气质量.有效控制空气中氮氧化物、碳氧化物和硫氧化物显得尤为重要.在汽车排气管内安装催化转化器,可将汽车尾气中主要污染物转化为无毒的大气循环物质.
 如图为实验室制取蒸馏水的装置示意图,请根据图示回答下列问题.
如图为实验室制取蒸馏水的装置示意图,请根据图示回答下列问题.