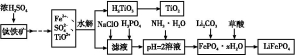
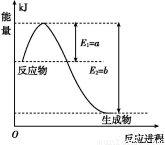
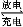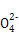题目内容
苯甲酸广泛应用于制药和化工行业。某同学尝试用甲苯的氧化反应制备苯甲酸。反应原理:
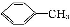 +2KMnO4
+2KMnO4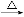
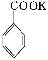 +KOH+
+KOH+
2MnO2↓+H2O
 +HCl
+HCl
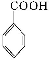 +KCl
+KCl
实验方法:一定量的甲苯和KMnO4溶液在100 ℃反应一段时间后停止反应,按如下流程分离出苯甲酸和回收未反应的甲苯。
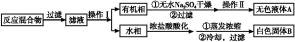
已知:苯甲酸分子量122,熔点122.4 ℃,在25 ℃和95 ℃时溶解度分别为0.3 g和6.9 g;纯净固体有机物一般都有固定熔点。
(1)操作Ⅰ为 ,操作Ⅱ为 。
(2)无色液体A是 ,定性检验A的试剂是 ,现象是 。
(3)测定白色固体B的熔点,发现其在115 ℃开始熔化,达到130 ℃时仍有少量不熔。该同学推测白色固体B是苯甲酸与KCl的混合物,设计了如下方案进行提纯和检验,实验结果表明推测正确。请完成表中内容。
序号 | 实验方案 | 实验现象 | 结论 |
① | 将白色固体B加入水中,加热溶解, | 得到白色晶体和无色滤液 |
|
② | 取少量滤液于试管中, | 生成白色沉淀 | 滤液含Cl- |
③ | 干燥白色晶体, |
| 白色晶体 是苯甲酸 |
(4)纯度测定:称取1.220 g产品,配成100 mL甲醇溶液,移取25.00 mL溶液,滴定,消耗KOH的物质的量为2.40×10-3 mol。产品中苯甲酸质量分数的计算表达式为 ,计算结果为 (保留二位有效数字)。
(1)分液 蒸馏
(2)甲苯 酸性高锰酸钾试液 溶液褪色
(3)
序号 | 实验方案 | 实验现象 | 结论 |
① | 冷却、过滤 |
|
|
② | 滴入2~3滴AgNO3溶液 |
|
|
③ | 加热使其熔化 | 熔点为122.4 ℃ |
|
(4) ×100%=96%
×100%=96%
【解析】(1)有机相和水相是不互溶的,分离操作是分液;互溶的有机相要得到纯净有机物一般方法为蒸馏;
(2)从题给信息苯甲酸为白色固体可知,A为甲苯,B为苯甲酸;检验苯的同系物可以利用使酸性高锰酸钾溶液褪色来定性检验。
(3)由实验现象得到白色晶体和无色滤液可知,①中操作为固液分离操作;②检验Cl-应该用硝酸酸化的硝酸银溶液;③由题给信息,应该用检测熔点来检验物质的成分。
(4) +KOH
+KOH
 +H2O,
+H2O,
n

 =2.40×10-3 mol×
=2.40×10-3 mol× =9.60×10-3 mol
=9.60×10-3 mol
 %=
%= ×100%=96%
×100%=96%

阿司匹林(乙酰水杨酸, )是世界上应用最广泛的解热、镇痛和抗炎药。乙酰水杨酸受热易分解,分解温度为128~135 ℃。某学习小组在实验室以水杨酸(邻羟基苯甲酸)与醋酸酐[(CH3CO)2O]为主要原料合成阿司匹林,制备基本操作流程如下:
)是世界上应用最广泛的解热、镇痛和抗炎药。乙酰水杨酸受热易分解,分解温度为128~135 ℃。某学习小组在实验室以水杨酸(邻羟基苯甲酸)与醋酸酐[(CH3CO)2O]为主要原料合成阿司匹林,制备基本操作流程如下:
乙酸酐+水杨酸



 粗产品
粗产品



 乙酰水杨酸
乙酰水杨酸
(阿司匹林) 测熔点
测熔点
主要试剂和产品的物理常数
名称 | 相对分子质量 | 熔点或沸点(℃) | 水 |
水杨酸 | 138 | 158(熔点) | 微溶 |
醋酸酐 | 102 | 139.4(沸点) | 反应 |
乙酰水杨酸 | 180 | 135(熔点) | 微溶 |
请根据以上信息回答下列问题:
(1)制备阿司匹林时,要使用干燥的仪器的原因是 。
(2)①合成阿司匹林时,最合适的加热方法是 。
②加热后冷却,未发现被冷却容器中有晶体析出,此时应采取的措施是 。
③抽滤所得粗产品要用少量冰水洗涤,则洗涤的具体操作是 。
(3)试剂A是 。
另一种改进的提纯方法如下:
粗产品



 乙酰水杨酸
乙酰水杨酸
(4)改进的提纯方法中加热回流的装置如图所示,

①使用温度计的目的是 。
②此种提纯方法中乙酸乙酯的作用是: ,所得产品的有机杂质要比原方案少,原因是 。