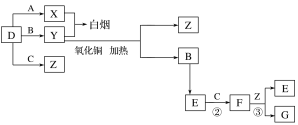
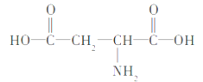题目内容
【题目】(1)甲烷的结构式是______乙烯的电子式是______将6.72L(标准状况)乙烯和甲烷的混合气通入足量的溴水中,充分反应后,溴水的质量增加了4g,原混合气体中乙烯和甲烷的物质的量之比是______
(2)在烷烃分子中,每增加一个碳原子,1mol烷烃完全燃烧需要多消耗氧气(填字母)______
A.1mol B.1.5mol C.2mol D.2.5mol
(3)乙醇分子内有四种不同的化学键(如图) ,在不同的化学反应中会断裂不同的化学键,请写出下列反应的化学方程式,并指出反应时乙醇分子中断裂的化学键
,在不同的化学反应中会断裂不同的化学键,请写出下列反应的化学方程式,并指出反应时乙醇分子中断裂的化学键
A.乙醇在Cu催化下发生氧化反应:_________________,断裂(填序号)___化学键;
B.乙醇中投入钠粒冒气泡:_____________,断裂(填序号)___化学键
【答案】
![]() 1:5 B 2CH3CH2OH+O2
1:5 B 2CH3CH2OH+O2![]() 2CH3CHO+2H2O ①③ 2C2H5OH+2Na
2CH3CHO+2H2O ①③ 2C2H5OH+2Na![]() 2C2H5ONa+H2↑ ③
2C2H5ONa+H2↑ ③
【解析】
(1)甲烷的结构式为 ,乙烯的电子式为
,乙烯的电子式为![]() ,标准状况6.72L(0.3mol)乙烯和甲烷的混合气通入足量的溴水中,充分反应后,溴水的质量增加了4g,则这4g为乙烯和溴反应增重的质量(0.05mol),故有0.05mol乙烯参加反应,甲烷有0.25mol,乙烯和甲烷的物质的量比为1:5;
,标准状况6.72L(0.3mol)乙烯和甲烷的混合气通入足量的溴水中,充分反应后,溴水的质量增加了4g,则这4g为乙烯和溴反应增重的质量(0.05mol),故有0.05mol乙烯参加反应,甲烷有0.25mol,乙烯和甲烷的物质的量比为1:5;
(2)烷烃分子中,每增加一个C原子,需要增加2个H原子,在燃烧时需要增加1.5mol氧气,故选B;
(3)A.乙醇的催化氧化反应方程式为2CH3CH2OH+O2![]() 2CH3CHO+2H2O,在反应过程中,羟基上的氢和羟基碳上的氢发生反应,故断键为①③键;B.乙醇和Na可以发生反应,方程式为2C2H5OH+2Na
2CH3CHO+2H2O,在反应过程中,羟基上的氢和羟基碳上的氢发生反应,故断键为①③键;B.乙醇和Na可以发生反应,方程式为2C2H5OH+2Na![]() 2C2H5ONa+H2↑,断键为①键。
2C2H5ONa+H2↑,断键为①键。

 口算题卡加应用题集训系列答案
口算题卡加应用题集训系列答案 综合自测系列答案
综合自测系列答案【题目】氧元素和卤族元素都能形成多种物质,我们可以利用所学物质结构与性质的相关知识去认识和理解。
(1)COCl2的空间构型为______________,溴的基态原子价电子排布式为_____________。
(2)已知CsICl2不稳定,受热易分解,倾向于生成晶格能更大的物质,则它按下列_____________(填字母)式发生。
A.CsICl2====CsCl+ICl B.CsICl2====CsI+Cl2
(3)根据表提供的第一电离能数据判断,最有可能生成较稳定的单核阳离子的卤素原子是____。
元素 | 氟 | 氯 | 溴 | 碘 |
第一电离能/ (kJ·mol-1) | 1681 | 1251 | 1140 | 1008 |
(4)下列分子既不存在“s-p”σ键,也不存在“p-p”π键的是__________(填字母)。
A.HCl B.HF C.SO2 D.SCl2
(5)已知ClO2-为“V”形,中心氯原子周围有4对价层电子。ClO2-中心氯原子的杂化轨道类型为______________,写出一个与CN—互为等电子体的物质的分子式:______________。
(6)钙在氧气中燃烧时得到一种钙的氧化物晶体,其结构如图所示,由此可判断钙的氧化物的化学式为__________。已知该氧化物的密度是ρg·cm-3,则晶胞内离得最近的两个钙离子的间距为_________cm(只要求列算式,不必计算出数值,阿伏加德罗常数的值为NA)。