题目内容
【题目】设计出燃料电池使汽油氧化直接产生电流是本世纪最具有挑战性的课题之一。最近有人制造了一种燃料电池,一个极通入空气,另一个极通入汽油蒸气,电池的电解质是掺杂了Y2O3的ZrO2晶体,它在高温下能传导O2-,回答如下问题:
⑴以丁烷为汽油代表,这个电池放电时发生的化学反应的方程式是:_______;
⑵这个电池负极发生的反应是:C4H10+13O2--26e-=4CO2+5H2O,正极发生的反应是:____;固体电解质里O2-的移动方向是:_____;向外电路释放电子的电极是:___;
⑶人们追求燃料电池氧化汽油而不在内燃机里燃烧汽油产生动力的主要原因是:_______;
⑷汽油燃料电池最大的障碍是氧化反应不完全产生_____堵塞电极的气体通道,有人估计,完全避免这种副反应至少还需10年,这正是新一代化学家的历史使命。
⑸碳氢化合物完全燃烧生成CO2和H2O。常温常压下,空气中的CO2,溶于水达到平衡时,溶液的溶液的pH=5.6, c(H2CO3)=1.5×10-5mol·L-1。若忽略水的电离及H2CO3的第二级电离,则H2CO3 H++HCO3-的平衡常数K1=____(已知:10-5.60=2.5×10-6)。
【答案】2C4H10+13O2=8CO2+10H2O O2+4e-=2O2- 向负极移动 负极 燃料电池具有较高的能量利用率 碳粒 4.2×10-7
【解析】
(1)燃料电池的总反应和燃料燃烧的化学方程式一致,则电池总反应为2C4H10+13O2=8CO2+10H2O,故答案为:2C4H10+13O2=8CO2+10H2O;
(2)丁烷燃料电池放电时,氧气在正极得到电子发生还原反应生成O2-,电极反应式为O2+4e-=2O2-,电解质里的阳离子移向正极,阴离子移向负极,所以电解质里O2-移向负极,负极上甲烷失去电子发生氧化反应,向外电路释放电子,故答案为:O2+4e-=2O2-;向负极移动;负极;
(3)原电池具有能量利用率高的特点,而燃烧时化学能转变为热能和光能,故答案为:燃料电池具有较高的能量利用率;
(4)烷不完全氧化会生成碳粒,从而堵塞电极的气体通道,故答案为:碳粒;
(5)由题意可知,溶液中c(H+)=c(HCO3-)=10-5.60=2.5×10-6mol/L,c(H2CO3)=1.5×10-5mol L,则H2CO3 ![]() H++HCO3-的平衡常数K1=
H++HCO3-的平衡常数K1=![]() =
=![]() =4.2×10-7,故答案为:=4.2×10-7。
=4.2×10-7,故答案为:=4.2×10-7。

 目标测试系列答案
目标测试系列答案【题目】甲、乙、丙、丁均为中学化学中常见的单质或化合物,它们之间的转化关系如下图所示(部分产物已略去),下列各组物质中不能按图示关系转化的是
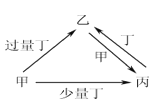
选项 | 甲 | 乙 | 丙 | 丁 |
A | NaOH | NaHSO3 | Na2SO3 | SO2 |
B | Fe | Fe(NO3)3 | Fe(NO3)2 | HNO3 |
C | C | CO2 | CO | O2 |
D | Al | NaAlO2 | Al(OH)3 | NaOH |
A. A B. B C. C D. D