题目内容
NA表示阿伏加德罗常数,下列叙述正确的是( )
| A.常温下,9g H2O中含NA个O–H键 |
| B.1 molFe2+与足量稀硝酸反应,转移3 NA个电子 |
| C.常温常压下,22. 4L SO2和O2的混合气体中含2NA个氧原子 |
| D.0. 1 mol·L–1KAl(SO4)2溶液中含0.2NA个SO42- |
A
解析试题分析:H2O分子的结构式为H-O-H,因此9g水中含有0.5mol水分子,总共含有O-H单键NA个,A正确;1 molFe2+与被足量稀硝酸氧化为Fe3+,转移3NA个电子,B错误;常温常压下混合气体的体积不可计算,C错误;D项中的硫酸铝溶液没有给出体积,硫酸根离子的数目不可计算,D错误;故选A。
考点:本题考查的阿伏伽德罗常数的计算。

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
下列有关化学用语的使用正确的是
A.HCl的电子式: |
B.镁的原子结构示意图: |
C.溴化钠的电子式:  |
| D.Na2SO4的电离方程式:Na2SO4=Na++ SO42- |
下列有关化学用语不能表示2-丁烯的是( )
A. | B.CH3CH=CHCH3 | C. | D. |
部分氧化的Fe-Cu合金样品(氧化产物为Fe2O3、CuO)共5.76g,如附图所示流程处理,下列说法中,正确的是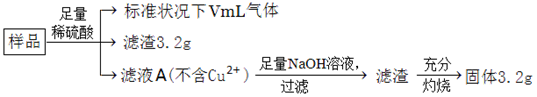
| A.滤液A中阳离子为Fe2+、H+ |
| B.样品中金属Fe的质量为2.14g |
| C.样品中CuO的质量为4.0g |
| D.V=448 |
下列化学用语表示正确的是
| A.表示氢气燃烧热的热化学方程式:2H2(g)+O2(g)= 2H2O(1)△H= -571.6kJ/mol |
B.肥皂(主要成分为RCOONa)的水溶液显碱性:RCOO-+H2O RCOOH+OH- RCOOH+OH- |
C.实验室制氯气的离子方程式:MnO2+4H++4Cl- MnCl2+2H2O+Cl2↑ MnCl2+2H2O+Cl2↑ |
D.乙酸与乙醇反应的化学方程式:CH3CO18OH+C2H5OH CH3CO18OC2H5+H2O CH3CO18OC2H5+H2O |
下列说法正确的是
| A.欲配制1.00L 1.00mol·L-1的NaCI溶液,可将58.5g NaC1溶于1.00L水中 |
| B.0.2mol Na2O2与足量水反应,转移电子数为0.4NA |
| C.同温同压下,质量相同的SO2气体和CO2气体的体积比等16:11 |
| D.1.0L 1.0mol ·L-l的Na2CO3水溶液中含有的氧原子数大于2NA |
设NA为阿伏加德罗常数的值,下列叙述正确的是
| A.标准状况下,33.6 L氟化氢中含有氟原子的数目为1.5NA |
| B.常温常压下,7.0 g乙烯与丙烯的混合物中含有氢原子的数目为NA |
| C.1 mol Al3+离子含有的核外电子数为3NA |
| D.某密闭容器盛有0.1 mol N2和0.3 mol H2,在一定条件下充分反应,转移电子的数目为0.6NA |
NA为阿伏伽德罗常数的值.下列叙述正确的是
| A.1.0L1.0mo1·L-1的NaAlO2水溶液中含有的氧原子数为2NA |
| B.12g石墨烯(单层石墨)中含有六元环的个数为0.5NA |
| C.25℃时pH=13的NaOH溶液中含有OH一的数目为0.1 NA |
| D.1mol的羟基与1 mol的氢氧根离子所含电子数均为9NA |
34 g FeSO4·7H2O样品在隔绝空气条件下受热脱水过程的热重曲线(样品质量随温度变化的曲线)如图所示。下列说法中正确的是
| A.温度为78℃时固体物质M的化学式为FeSO4·5H2O |
| B.温度为159℃时固体物质N的化学式为FeSO4·3H2O |
C.在隔绝空气条件下由N得到P的化学方程式为FeSO4 FeO+SO3↑ FeO+SO3↑ |
| D.取适量380℃时所得的样品P,隔绝空气加热至650℃,得到一种固体物质Q,同时有两种无色气体生成,Q的化学式为Fe2O3 |