题目内容
12.按要求写出化学反应方程式实验室用二氧化锰和浓盐酸反应制备氯气MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O.
分析 二氧化锰与浓盐酸在加热条件下反应生成氯化锰和氯气、水.
解答 解:二氧化锰与浓盐酸在加热条件下反应生成氯化锰和氯气、水,化学方程式:MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O;
故答案为:MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O.
点评 本题考查了氯气的实验室制备原理,明确物质的性质和发生的化学反应是解题关键,注意方程式书写的方法,注意反应条件的标注,题目难度不大.

练习册系列答案
 第1卷单元月考期中期末系列答案
第1卷单元月考期中期末系列答案
相关题目
4.下表是某地区市场上销售的一种“加碘食盐”包装袋上的部分文字说明.请根据此表,结合初中化学和生物学科的知识,回答下列问题.
(1)碘是合成下列哪种激素的主要原料之一B
A.胰岛素 B.甲状腺素 C.生长激素 D.雄性激素
(2)长期生活在缺碘山区,又得不到食盐供应,易患C
A.甲状腺亢进 B.贫血症 C.地方性甲状腺肿大 D.糖尿病
(3)食盐中加碘,这碘指的是元素(填元素、原子或单质).
(4)碘酸钾的化学式为KIO3,其中碘元素的化合价为+5.
(5)根据含碘盐的食用方法可推测碘元素的化学性质,碘酸钾在受热时容易分解.
(6)已知可用盐酸酸化的碘化钾淀粉溶液,检查食盐中含碘酸钾(进行如下反应:IO3-+5I-+6H+═3I2+3H2O).现有①纯净水、②白酒、③食醋、④淀粉KI试纸、⑤纯碱,试从中选择必须的物质检验食盐样品中是否加入碘,选择的物质①③④(填序号).
| 配料表 | 精制海盐、碘酸钾[ |
| 含碘量 | 20~40mg/kg |
| 卫生许可证号 | ××卫碘字(1999)第001号 |
| 分装日期 | 见封底 |
| 储藏方法 | 密封、避光、防潮 |
| 食用方法 | 烹调时,待食品熟后加入碘盐 |
A.胰岛素 B.甲状腺素 C.生长激素 D.雄性激素
(2)长期生活在缺碘山区,又得不到食盐供应,易患C
A.甲状腺亢进 B.贫血症 C.地方性甲状腺肿大 D.糖尿病
(3)食盐中加碘,这碘指的是元素(填元素、原子或单质).
(4)碘酸钾的化学式为KIO3,其中碘元素的化合价为+5.
(5)根据含碘盐的食用方法可推测碘元素的化学性质,碘酸钾在受热时容易分解.
(6)已知可用盐酸酸化的碘化钾淀粉溶液,检查食盐中含碘酸钾(进行如下反应:IO3-+5I-+6H+═3I2+3H2O).现有①纯净水、②白酒、③食醋、④淀粉KI试纸、⑤纯碱,试从中选择必须的物质检验食盐样品中是否加入碘,选择的物质①③④(填序号).
20.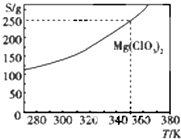 Mg(ClO3)2在农业上可用做脱叶剂、催熟剂.可采用复分解反应制备:MgCl2+2NaClO3═Mg(ClO3)2+2NaCl.已知Mg(ClO3)2的溶解度(S)随温度(T)的变化曲线如图所示.下列有关叙述中不正确的是( )
Mg(ClO3)2在农业上可用做脱叶剂、催熟剂.可采用复分解反应制备:MgCl2+2NaClO3═Mg(ClO3)2+2NaCl.已知Mg(ClO3)2的溶解度(S)随温度(T)的变化曲线如图所示.下列有关叙述中不正确的是( )
 Mg(ClO3)2在农业上可用做脱叶剂、催熟剂.可采用复分解反应制备:MgCl2+2NaClO3═Mg(ClO3)2+2NaCl.已知Mg(ClO3)2的溶解度(S)随温度(T)的变化曲线如图所示.下列有关叙述中不正确的是( )
Mg(ClO3)2在农业上可用做脱叶剂、催熟剂.可采用复分解反应制备:MgCl2+2NaClO3═Mg(ClO3)2+2NaCl.已知Mg(ClO3)2的溶解度(S)随温度(T)的变化曲线如图所示.下列有关叙述中不正确的是( )| A. | 温度越高,Mg(ClO3)2饱和溶液的物质的量浓度越大 | |
| B. | 温度越高,Mg(ClO3)2饱和溶液的质量分数越大 | |
| C. | 350K时,Mg(ClO3)2饱和溶液的物质的量浓度为$\frac{250g}{191g/mol×1L}$ | |
| D. | 350 K时,Mg(ClO3)2饱和溶液的质量分数为$\frac{250g}{350g}$×100% |
7.实验室保存下列化学试剂的方法正确的是( )
| A. | 水玻璃保存在带磨口玻璃塞的试剂瓶中 | |
| B. | 少量金属钠可保存在煤油中,大量的金属钠可保存在液体石蜡中 | |
| C. | 氢氟酸保存在磨口试剂瓶中 | |
| D. | 液溴密封盛放在无色试剂瓶中,并在液面上放一层水 |
17.将10mL饱和碘水与4mL苯混合于试管中,用力震荡后静置,实验现象为( )
| A. | 溶液不分层,呈现黄色 | B. | 溶液分层,上层为水层,无色 | ||
| C. | 溶液分层,上层为苯层,紫色 | D. | 溶液分层,下层为苯层,紫色 |
4.对于常温下PH为2的盐酸,下列叙述正确的是( )
| A. | c(H+)=c(Cl-)+c(OH-) | |
| B. | 由水电离出的c(H+)=1.0×10ˉ 2 mol•Lˉ1 | |
| C. | 与等体积PH=12的氨水混合后所得溶液显中性 | |
| D. | 与等体积0.01 mol•Lˉ1CH3COONa溶液混合后所得溶液中:c(Cl-)=c(CH3COO-) |
1.已知常温下在溶液中可发生如下两个离子反应:
①Ge4++Fe2+═Fe3++Ge3+
②Sn2++2Fe3+═2Fe2++Sn4+
由此可以确定Fe2+、Ge3+、Sn2+三种离子的还原性由强到弱的顺序是( )
①Ge4++Fe2+═Fe3++Ge3+
②Sn2++2Fe3+═2Fe2++Sn4+
由此可以确定Fe2+、Ge3+、Sn2+三种离子的还原性由强到弱的顺序是( )
| A. | Sn2+、Fe2+、Ge3+ | B. | Sn2+、Ge3+、Fe2+ | C. | Ge3+、Fe2+、Sn2+ | D. | Fe2+、Sn2+、Ge3+ |
2.标准状况下,CO和CO2组成的混合气体2.24L,混合气体的质量为4g,则CO和CO2 的物质的量之比为( )
| A. | 1:3 | B. | 3:1 | C. | 1:1 | D. | 1:2 |