题目内容
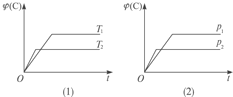
【题目】某温度下, pH值相同的盐酸和醋酸溶液分别稀释,平衡pH值随溶液体积变化的曲线如下图所示。据图判断下列叙述中,正确的是
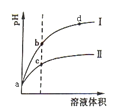
A.曲线Ⅰ为醋酸稀释时pH值变化曲线
B.b点溶液中水的电离程度比c点溶液中水的电离程度大
C.a点时,加入相同大小的锌粒,与盐酸反应的速率大
D.加入足量NaOH,b点溶液消耗的NaOH比c点溶液消耗的多
【答案】B
【解析】
正确答案:B
A.不正确,曲线Ⅰ为盐酸稀释时pH值变化曲线,醋酸是弱酸,稀释时pH值变化曲线Ⅱ;
B.正确,b点酸性小,对溶液中水的电离程度抑制小,比c点溶液中水的电离程度大;
C.不正确,a点时,加入相同大小的锌粒,两者H+ 的浓度相同,反应的速率相同;
D.不正确,加入足量NaOH,b点溶液消耗的NaOH比c点溶液消耗的少,c点浓度大。

【题目】某实验小组研究水样中污染物X在不同影响因素下的分解速率,测得X的物质的量浓度(![]() )随时间(min)变化的实验数据如下:
)随时间(min)变化的实验数据如下:
温度 | 时间 浓度 水样 | 0 | 10 | 20 | 30 | 40 |
| I | 0.80 | 0.68 | 0.60 | 0.56 | 0.54 |
| II | 1.60 | 1.34 | 1.20 | 1.08 | 1.02 |
| III | 1.60 | 1.26 | 1.08 | 0.94 | 0.94 |
下列说法不正确的是
A. ![]() 温度下水样I中,
温度下水样I中,![]() 之间X分解的平均反应速率为
之间X分解的平均反应速率为![]()
B. ![]() 温度下水样Ⅱ中,
温度下水样Ⅱ中,![]() 时X的浓度小于
时X的浓度小于![]()
C. ![]() 温度下水样Ⅲ中,从反应开始到达到平衡,X分解的平均反应速率为
温度下水样Ⅲ中,从反应开始到达到平衡,X分解的平均反应速率为![]()
D. 由表中数据推测,![]()
【题目】二氧化碳利用具有十分重要的意义,科学家有以下几个设想。
(1)用太阳能将CO2转化成O2和C(石墨烯),其设想如图:
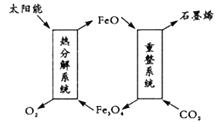
则重整系统发生反应的化学方程式为_________。
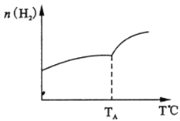
(2)二氧化碳和氢气在催化剂作用下可制取低碳烯烃。在一密闭容器中分别投入1molCO2、3molH2,发生反应:2CO2(g)+6H2(g)![]() C2H4(g)+ 4H2O(g) △H;在不同温度下,用传感技术测出平衡时H2的物质的量变化关系如图所示。
C2H4(g)+ 4H2O(g) △H;在不同温度下,用传感技术测出平衡时H2的物质的量变化关系如图所示。
①其它条件不变,起始时若按lmolCO2、2molH2进行投料,CO2转化率将________(填“增大”、“ 减小”或“不变”);
②△H_____0(填“>”“<”“ 不能确定”)。
③若测试中体系内无氧气产生,试结合图示推断热稳定性C2H4 _____H2O (填“>”“<”“ 不能确定”)。
(3)用氨水吸收CO2制化肥(NH4HCO3)
①已知:NH3·H2O(aq)![]() NH4+(aq)+OH-(aq) △H1=akJ/mol
NH4+(aq)+OH-(aq) △H1=akJ/mol
CO2(g)+H2O(l)![]() H2CO3(aq) △H2=bkJ/mol
H2CO3(aq) △H2=bkJ/mol
H2CO3(aq)+OH-(aq)![]() HCO3-(aq)+H2O(l) △H3=ckJ/mol
HCO3-(aq)+H2O(l) △H3=ckJ/mol
则利用NH3 H2O吸收CO2制备NH4HCO3的热化学方程式为______________________;
②已知常温下相关数据如表:
Kb(NH3·H2O) | 2×10-5kJ/mol |
Ka1(H2CO3) | 4×10-7kJ/mol |
Ka2(H2CO3) | 4×10-11kJ/mol |
则反应NH4++HCO3-+H2O![]() NH3 H2O+H2CO3的平衡常数K=___________。
NH3 H2O+H2CO3的平衡常数K=___________。