题目内容
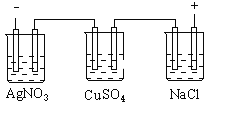
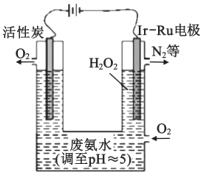
【题目】现代技术可利用电解法制H2O2并用产生的H2O2处理废氨水,其装置如图所示。下列说法正确的是( )
A.该过程的总反应为:3H2O2+8H++4NH3H2O=8H2O+N2↑+2NH4+
B.Ir-Ru惰性电极有吸附O2的作用,该电极上的反应为:O2+2H++2e-=H2O2
C.理论上电路中每转移6mol电子,最多可以处理NH3H2O的物质的量为1mol
D.为了不影响H2O2的产量,需要向废氨水中加入适量硝酸调节溶液的pH约为5,则所得的废氨水溶液中c(NH4+)>c(NO3-)
【答案】B
【解析】
根据装置图可得,活性炭与电源正极相连,则活性炭为阳极,Ir-Ru惰性电极为阴极,电解液为酸性,阳极上为阴离子放电,则OH-离子放电生成氧气,阳极电极反应为4OH--4e-=O2↑+2H2O,阴极上通入氧气生成H2O2,阴极电极反应为:O2+2H++2e-=H2O2,据此分析解答。
A.根据分析,阳极电极反应为4OH--4e-=O2↑+2H2O,阴极电极反应为:O2+2H++2e-=H2O2,电解池的总反应为:2H2O+O2=2H2O2,双氧水处理氨水,反应为:3H2O2+2NH3= N2↑+6H2O,两式合并,则该过程的总反应为:4NH3+3O2=2N2+6H2O,故A错误;
B.利用电解法制H2O2,在该电解池中,Ir-Ru惰性电极有吸附O2作用为氧气得电子发生还原反应,该电极上的反应为: O2+2H++2e-=H2O2,故B正确;
C.根据分析,该过程的总反应为:4NH3+3O2=2N2+6H2O中,氨气中的氮元素从-3价变为氮气中的0价,4mol氨气转移12mol电子,所以理论上电路中每转移6mol电子,最多可以处理NH3H2O的物质的量为2mol,故C错误;
D.向废氨水加入适量硝酸调节溶液的pH约为5,根据溶液呈电中性,溶液中存在电荷守恒:c(NH4+)+c(H+)=c(NO3)+c(OH),pH约为5呈酸性,c(H+)>c(OH),所以c(NH4+)<c(NO3),故D错误;
答案选B。

 阅读快车系列答案
阅读快车系列答案