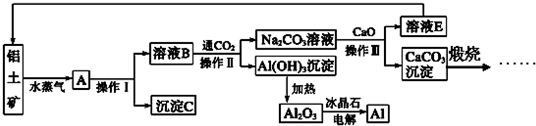
题目内容
工业上用铝土矿(含氧化铝、氧化铁)制取铝的过程如下:
请回答下列问题:
(1)操作I、操作II、操作III都是
(2)生产过程中,除NaOH、H2O可以循环使用外,还可以循环使用的物质有
(3)写出Na2CO3溶液与CaO反应离子方程式:
(4)若铝土矿中还含有二氧化硅,此生产过程中得到的氧化铝将混有杂质:
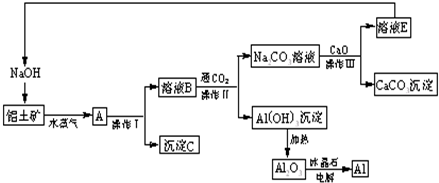
请回答下列问题:

(1)操作I、操作II、操作III都是
过滤
过滤
(填操作名称),实验室要洗涤Al(OH)3沉淀应该在过滤器
过滤器
装置中进行.(2)生产过程中,除NaOH、H2O可以循环使用外,还可以循环使用的物质有
CaO和CO2
CaO和CO2
(填化学式).用此法制取铝得到的副产品是Fe2O3和O2
Fe2O3和O2
(填化学式).(3)写出Na2CO3溶液与CaO反应离子方程式:
CO32-+CaO+H2O═CaCO3↓+2OH-
CO32-+CaO+H2O═CaCO3↓+2OH-
.(4)若铝土矿中还含有二氧化硅,此生产过程中得到的氧化铝将混有杂质:
SiO2
SiO2
(填化学式).分析:(1)固体和液体的分离用过滤的方法,沉淀的洗涤用过滤装置,熟记沉淀的洗涤方法;
(2)根据流程可以确定能循环使用的物质以及流程的副产物;
(3)Na2CO3溶液与CaO反应的实质是碳酸钠和氢氧化钙的反应;
(4)根据二氧化硅的性质来分析.
(2)根据流程可以确定能循环使用的物质以及流程的副产物;
(3)Na2CO3溶液与CaO反应的实质是碳酸钠和氢氧化钙的反应;
(4)根据二氧化硅的性质来分析.
解答:解:(1)实现固体和液体的分离采用过滤法,实验室要洗涤Al(OH)3沉淀是在过滤器中进行的,具体操作为:漏斗中加蒸馏水至浸没沉淀,使水自然流完,重复操作2~3次,
故答案为:过滤;过滤器;
(2)对碳酸钙高温煅烧生成的氧化钙可以再和碳酸钠水溶液作用,生成的二氧化碳还可以用来处理溶液B,二者均可以循环使用,该方案中的沉淀C氧化铁和电解铝生成的氧气是副产物,故答案为:CaO和CO2;Fe2O3和O2;
(3)Na2CO3溶液与CaO反应的实质是CO32-+CaO+H2O═CaCO3↓+2OH-,故答案为:CO32-+CaO+H2O═CaCO3↓+2OH-;
(4)二氧化硅能和强碱氢氧化钠反应生成硅酸钠,硅酸钠和二氧化碳反应生成难溶物质硅酸,受热分解产生二氧化硅,所以若铝土矿中还含有二氧化硅,此生产过程中得到的氧化铝将混有杂质二氧化硅,故答案为:SiO2.
故答案为:过滤;过滤器;
(2)对碳酸钙高温煅烧生成的氧化钙可以再和碳酸钠水溶液作用,生成的二氧化碳还可以用来处理溶液B,二者均可以循环使用,该方案中的沉淀C氧化铁和电解铝生成的氧气是副产物,故答案为:CaO和CO2;Fe2O3和O2;
(3)Na2CO3溶液与CaO反应的实质是CO32-+CaO+H2O═CaCO3↓+2OH-,故答案为:CO32-+CaO+H2O═CaCO3↓+2OH-;
(4)二氧化硅能和强碱氢氧化钠反应生成硅酸钠,硅酸钠和二氧化碳反应生成难溶物质硅酸,受热分解产生二氧化硅,所以若铝土矿中还含有二氧化硅,此生产过程中得到的氧化铝将混有杂质二氧化硅,故答案为:SiO2.
点评:此题是一道物质的制备考查题,根据图示中物之间的反应情况对相关的问题进行探讨分析即可.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目