题目内容
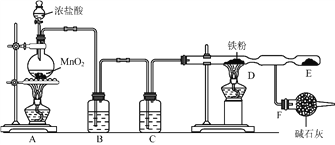
【题目】某化学兴趣小组用稀硫酸和高纯度锌粒按如图所示装置制取H2并还原CuO时,发现尾气略有刺激性。通过进一步探究,证明尾气中含有SO2。
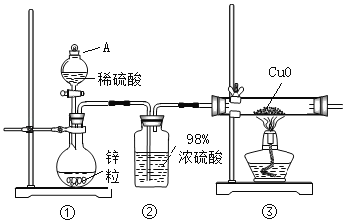
(1)A装置的名称_____;②装置中浓硫酸的作用_____;
(2)经讨论,认为SO2的产生有以下两种可能:
甲同学:_____反应产生了SO2;
乙同学:H2与②装置中浓硫酸反应产生了SO2;
请完善甲同学的猜想,并结合供选试剂设计简单方案求证乙同学猜想的合理性。(仪器任选;除上述试剂外,可另选试剂如下:稀盐酸、稀硝酸、无水氯化钙、碱石灰)________________________
(3)如果乙同学猜想成立,请用化学方程式表示其原理_____;
(4)已知常温下H2不能与酸性高锰酸钾溶液反应,有同学提出可以在②装置前用酸性高锰酸钾溶液除去SO2,请用离子方程式表示反应的原理:_____;
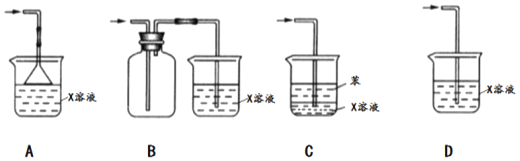
(5)SO2是一种有毒的污染性气体,实验室常用X溶液进行尾气处理,X是_____(填化学式);尾气吸收时下列装置不能起到防倒吸效果的是_____(填选项)。
【答案】分液漏斗 干燥 锌粒与硫酸
方案一 | A中用稀盐酸代替稀硫酸 | 若收集到的气体依然含有二氧化硫 | 乙的猜想正确 |
方案二 | ②装置中用装无水氯化钙的球形干燥管代替浓硫酸 | 若收集到的气体不含二氧化硫 | 乙的猜想正确 |
H2+H2SO4(浓)=SO2+2 H2O 5SO2+2MnO4﹣+2H2O=5SO42﹣+2Mn 2++4H+ NaOH BCD
【解析】
(1)根据装置图确定仪器的名称;浓硫酸具有吸水性,常用作干燥剂;
(2)二氧化硫的产生可能是锌粒与硫酸反应生成的,也可能是H2与②装置中浓硫酸反应产生了SO2,据此两位同学进行猜想;
(3)氢气与浓硫酸反应,生成SO2和水;
(4)高锰酸钾具有强氧化性,可将SO2氧化为SO42-,自身被还原为Mn2+;
(5)SO2为酸性气体,用碱液进行尾气吸收。
(1)由装置图可知,A为分液漏斗;②浓硫酸吸收随氢气出来的水份,起干燥的作用;
故答案为:分液漏斗;干燥;
(2)二氧化硫的产生可能是锌粒与硫酸反应生成的,也可能是H2与②装置中浓硫酸反应产生了SO2,所以甲同学的猜测为锌粒与硫酸反应;方案一:A中用稀盐酸代替稀硫酸,若收集到的气体依然含SO2则乙猜想正确;方案二:②装置中用装无水氯化钙的球形干燥管代替浓硫酸,若收集到的气体不含SO2则乙猜想正确;
方案一 | A中用稀盐酸代替稀硫酸 | 若收集到的气体依然含有二氧化硫 | 乙的猜想正确 |
方案二 | ②装置中用装无水氯化钙的球形干燥管代替浓硫酸 | 若收集到的气体不含二氧化硫 | 乙的猜想正确 |
(3)如果乙同学猜想成立,则氢气与浓硫酸反应生成二氧化硫与水,方程式为:H2+H2SO4(浓)=SO2+2 H2O;
(4)酸性高锰酸钾与二氧化硫发生氧化还原反应,得到硫酸根离子和二价锰离子,其离子方程式为:5SO2+2MnO4﹣+2H2O=5SO42﹣+2Mn 2++4H+;
(5)二氧化硫是有毒性气体,必须进行尾气的处理,常用碱液来吸收,故用氢氧化钠溶液,尾气吸收时装置要防倒吸,A中漏斗可以防止倒吸,BCD均插入在溶液中,溶液易倒吸。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案