题目内容
16.已知在酸性溶液中,下列物质与KI发生氧化还原反应,其还原产物对应为:MnO4-→Mn2+,Cl2→Cl-;Fe3+→Fe2+;HNO3→NO.如果将等物质的量的KI氧化成I2,所用物质的量浓度相同的四种溶液中体积最少的是( )
| A. | Cl2 | B. | Fe3+ | C. | HNO3 | D. | MnO4- |
分析 如果将等物质的量的KI氧化成I2,则所有反应中转移电子相等,这几种溶液的物质的量浓度相等,如果试剂中微粒元素化合价变化越大,则需要试剂体积越少,据此分析解答.
解答 解:如果将等物质的量的KI氧化成I2,则所有反应中转移电子相等,这几种溶液的物质的量浓度相等,如果试剂中微粒元素化合价变化越大,则需要试剂体积越少,
MnO4-→Mn2+中Mn元素化合价由+7价变为+2价,变化值为5;
Cl2→Cl-中Cl元素化合价由0价变为-1价,每个氯气分子化合价变化值为2;
Fe3+→Fe2+中Fe元素化合价由+3价变为+2价,化合价变化值为1;
HNO3→NO中N元素化合价由+5价变为+2价,化合价变化值为3,
通过以上分析知,需要试剂体积大小顺序是Fe3+→Fe2+、Cl2→Cl-、HNO3→NO、MnO4-→Mn2+,所以最少的是MnO4-→Mn2+,故选D.
点评 本题考查氧化还原反应有关计算,为高频考点,明确转移电子相等是解本题关键,再结合元素化合价变化分析解答,熟悉常见元素化合价,题目难度不大.

练习册系列答案
 优学名师名题系列答案
优学名师名题系列答案
相关题目
6.同温同压下,同体积的一氧化碳与乙烯(C2H4)相比较,下列叙述不正确的是( )
| A. | 质量比和密度比均为1:1 | |
| B. | 质子数之比为7:8 | |
| C. | 二者所含原子数之比为1:2 | |
| D. | 二者完全燃烧产生二氧化碳的物质的量之比为1:2 |
7.下列表达式错误的是( )
| A. | 碳-12原子表示为${\;}_{6}^{12}$C | |
| B. | 氮原子的L层电子的电子排布图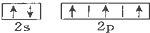 | |
| C. | 硫离子的核外电子排布式1s22s22p63s23p6 | |
| D. | NH4Cl的电子式为: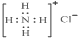 |
4.某元素原子核内质子数为m,中子数为n,则下列论断正确的是( )
| A. | 这种元素的相对原子质量为m+n | |
| B. | 若碳原子质量为wg,则此原子的质量为(m+n)wg | |
| C. | 不能由此确定该元素的相对原子质量 | |
| D. | 核内中子的总质量小于质子的总质量 |
11.下列叙述正确的是( )
| A. | 醋酸溶液的pH=a,将此溶液加水稀释后,溶液中各微粒浓度均减小 | |
| B. | 将浓度均为0.01 mol•L-1的CH3COOH和CH3COONa溶液等体积混合后,溶液中:c(CH3COOH)+c(CH3COO-)=0.01mol•L-1 | |
| C. | 将等体积,pH值均为3的醋酸和盐酸,分别加水稀释至amL和bmL,稀释后溶液的pH值均为5,则b>a=100 | |
| D. | 一定温度下,向0.1mol•L-1的醋酸溶液中加少量烧碱,溶液中$\frac{c({H}^{+})}{c(C{H}_{3}COOH)}$的比值增大 |
20.(1)短周期元素中原子核外p轨道上电子数与s轨道上电子总数相等的元素是O、Mg(写元素符号).
(2)Ti(BH4)2是一种重要的储氢材料.在基态Ti2+中,电子占据的最高能层符号为M,该能层具有的原子轨道数为9.
(3)H2S和H2O2的主要物理性质如表所示:
H2S和H2O2的相对分子质量基本相同,造成上述物理性质差异的主要原因是H2O2分子之间会形成氢键,熔沸点高,H2O2与水分子之间会形成氢键,溶解度大.
(4)金属镍粉在CO气流中轻微加热,生成无色挥发性液体Ni(CO)n,与Ni(CO)n中配体互为等电子体的离子的化学式为CN-或C22-(写出一个即可).
(5)已知CrO5中Cr为+6价,则CrO5的结构式为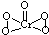 .
.
(2)Ti(BH4)2是一种重要的储氢材料.在基态Ti2+中,电子占据的最高能层符号为M,该能层具有的原子轨道数为9.
(3)H2S和H2O2的主要物理性质如表所示:
| 熔点/K | 沸点/K | 水中的溶解度(标准状况) | |
| H2S | 187 | 202 | 2.6 |
| H2O2 | 272 | 423 | 以任意比互溶 |
(4)金属镍粉在CO气流中轻微加热,生成无色挥发性液体Ni(CO)n,与Ni(CO)n中配体互为等电子体的离子的化学式为CN-或C22-(写出一个即可).
(5)已知CrO5中Cr为+6价,则CrO5的结构式为
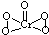 .
.  物质A、E、F的焰色反应呈黄色,物质I的1个分子由4个原子组成并共含有10个电子,B、C、D、K在常温下都是气体单质,G在常温下是无色液体,反应①~⑤都是用于工业生产的反应,各有关物质之间的相互反应转化关系如图所示(部分反应条件已略去):
物质A、E、F的焰色反应呈黄色,物质I的1个分子由4个原子组成并共含有10个电子,B、C、D、K在常温下都是气体单质,G在常温下是无色液体,反应①~⑤都是用于工业生产的反应,各有关物质之间的相互反应转化关系如图所示(部分反应条件已略去):
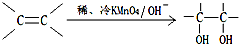 ).在下列转化关系中,P为高分子化合物.
).在下列转化关系中,P为高分子化合物.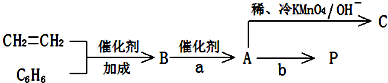
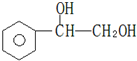 ,C与足量醋酸反应的化学方程式为
,C与足量醋酸反应的化学方程式为 ;
;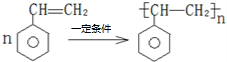 .
.