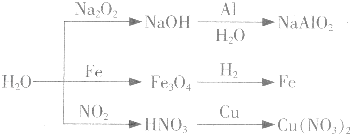
题目内容
【题目】将1mol纯净的A置于真空密闭容器中(假设容器体积不变,固体试样体积忽略不计),在恒定温度下使其分解达到平衡:A(s)![]() 2B(g) +C(g),下列可以判断该反应已达到化学平衡状态的是
2B(g) +C(g),下列可以判断该反应已达到化学平衡状态的是
A. 反应速率:vB(正)=vc(逆) B. B的体积分数不变
C. 气体的密度保持不变 D. 混合气体的平均摩尔质量保持不变
【答案】C
【解析】A、根据方程式可知反应速率:vB(正)=2vC(逆)时达到平衡状态,A错误;B、体系中气体只有B、C,无论是否达到了平衡状态,体积比始终是2:1,体积分数始终不变,B错误;C、根据ρ=m/V,容器容积不变,反应物A是固体,只要反应没有达到平衡状态,气体的质量就会改变,当达到了平衡状态后,气体的密度不变,C正确;D、体系中气体只有B、C,无论是否达到了平衡状态,体积比始终是2:1,混合气体的平均摩尔质量始终保持不变,D错误;答案选C。

【题目】苯乙烷(C8H10)可生产塑料单体苯乙烯(C8H8),其反应原理是C8H10(g)C8H8(g)+H2(g)△H>0 Ⅰ.某温度下,将0.40mol苯乙烷,充入2L真空密闭容器中发生反应,测定不同时间该容器内物质的量,得到数据如下表:
时间/min | 0 | 10 | 20 | 30 | 40 |
n(C8H10)/mol | 0.40 | 0.30 | 0.26 | n2[来源:] | n3 |
n(C8H8)/mol | 0.00 | 0.10 | n1 | 0.16 | 0.16 |
(1)当反应进行到20min时,该段时间内H2的平均反应速率是 .
(2)该温度下,该反应的化学平衡常数是 .
化学键 | C﹣H | C﹣C | C=C | H﹣H |
键能/kJmol1 | 412.5 | 348 | 612 | 436 |
(3)已知: 计算上述反应的△H=kJmol﹣1 . 若保持其他条件不变,用0.40mol H2(g)和0.40mol C8H8(g)合成C8H10(g),当有30kJ热量放出时,该反应中H2的转化率是 . 此时,该反应是否达到了平衡状态?(填“是”或“否”).
Ⅱ.工业上以高温水蒸气作为反应体系的稀释剂(不参与反应),C8H10(g)的平衡转化率与水蒸气的用量、体系的温度、压强的关系如图Ⅰ、图Ⅱ所示.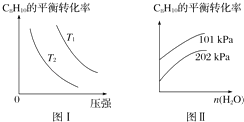
(4)由图Ⅰ可知,T1T2(填“大于”、“小于”或“等于”).
(5)由图Ⅱ可知,当其他条件不变时,水蒸气的用量越大,C8H10的平衡转化率将(填“越大”、“越小”或“不变”),原因是 .
【题目】900℃时,向2.0L恒容密闭容器中充入0.40mol乙苯,发生反应: ![]()
![]() +H2(g)△H=akJ.mol﹣1 . 经一段时间后达到平衡.反应过程中测定的部分数据见下表:
+H2(g)△H=akJ.mol﹣1 . 经一段时间后达到平衡.反应过程中测定的部分数据见下表:
时间/min | 0 | 10 | 20 | 30 | 40 |
n(乙苯)/mol | 0.40 | 0.30 | 0.24 | n2 | n3 |
n(苯乙烯)/mol | 0.00 | 0.10 | n1 | 0.20 | 0.20 |
下列说法正确的是( )
A.反应在前20 min的平均速率为v(H2)=0.004molL﹣1min﹣1
B.保持其他条件不变,升高温度,平衡时,c(乙苯)=0.08molL﹣1 , 则a<0
C.保持其他条件不变,向容器中充入不参与反应的水蒸气作为稀释剂,则乙苯的转化率为50.0%
D.相同温度下,起始时向容器中充入0.10mol乙苯、0.10mol苯乙烯和0.30molH2 , 达到平衡前v(正)>v(逆)