题目内容
下列现象与原子核外电子跃迁无关的是
| A.激光 | B.焰火 | C.核辐射 | D.霓虹灯光 |
C
解析试题分析:电子跃迁本质上是组成物质的粒子(原子、离子或分子)中电子的一种能量变化。核辐射是原子核从一种能量状态结构或转变为另一种结构或另一种能量状态过程中所释放出来的微观离子流,与电子跃迁无关。激光、霓虹灯广告、节日里燃放的焰火是原子的发射光谱,与原子核外电子发生跃迁有关,因此正确的答案选C。
考点:考查原子核外电子跃迁的有关判断和应用

练习册系列答案
相关题目
四种短周期元素在周期表中的相对位置如右表所示,下列说法错误的是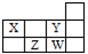
| A.X和Y元素的原子最外层电子数之和等于Z元素的原子最外层电子数的2倍 |
| B.Y元素的非金属性强于W元素的,其最高价氧化物水化物的酸性也强于W的 |
| C.X最简单氢化物溶于水呈碱性,Z最简单氢化物溶于水呈酸性 |
| D.W元素形成的单质可以从Z元素氢化物的水溶液中置换出Z单质 |
根据中学化学教材所附元素周期表判断,下列叙述不正确的是( )
| A.K层电子为奇数的所有元素所在族的序数与该元素原子的K层电子数相等 |
| B.L层电子为奇数的所有元素所在族的序数与该元素原子的L层电子数相等 |
| C.L层电子为偶数的所有主族元素所在族的序数与该元素原子的L层电子数相等 |
| D.M层电子为奇数的所有主族元素所在族的序数与该元素原子的M层电子数相等 |
元素周期表和元素周期律可以指导人们进行规律性的推测和判断。下列说法不合理的是( )
| A.若X+和Y2-的核外电子层结构相同,则原子序数:X>Y |
| B.由水溶液的酸性:HCl>H2S,可推断出元素的非金属性:Cl>S |
| C.硅、锗都位于金属与非金属的交界处,都可以做半导体材料 |
| D.Cs和Ba分别位于第六周期IA和IIA族,碱性:CsOH>Ba(OH)2 |
短周期元素的四种离子aW3+、bX+、cY2-、dZ- 它们的电子层结构相同,下列关系正确的是
| A.质子数c>d | B.离子的还原性Y2->Z- |
| C.氢化物的稳定性H2Y>HZ | D.原子半径X<W |
下列判断中一定正确的是
| A.若R2-和M+的电子层结构相同,则原子序数:R>M |
| B.若X、Y都是气态氢化物,且相对分子质量:X>Y,则沸点:X>Y |
| C.若M、N是同主族元素,且原子序数:M>N,则非金属性:M>N |
| D.若X、Y属于同主族元素,且相对原子质量:X>Y,则X失电子能力比Y的强 |
依据元素周期表及元素周期律,下列推断正确的是
| A.H3BO3的酸性比H2CO3的强 |
| B.Mg(OH)2的碱性比Be(OH)2的强 |
| C.HCl、HBr、HI的热稳定性依次增强 |
| D.若M+和R2-的核外电子层结构相同,则原子序数:R>M |
下列各项内容中,排列顺序正确的是( )
①固体的热稳定性:Na2CO3>CaCO3>NaHCO3 ②物质的熔点Li>Na>K
③微粒半径:K+>S2->F- ④单质的密度Na<K<Rb ⑤氢化物的沸点:H2Se>H2S>H2O
| A.①③ | B.②④ | C.①② | D.③⑤ |
依据元素周期表及元素周期律,下列推断正确的是
| A.HCl、HBr、HI的热稳定性依次增强 |
| B.若M+和R2-的核外电子层结构相同,则原子序数:R>M |
| C.同主族元素从上到下,单质的熔点逐渐降低 |
| D.同周期元素(除0族元素外)从左到右,原子半径逐渐减小 |