题目内容
某化肥厂用NH3制备NH4NO3,已知:由NH3制NO产率是96%,NO制HNO3产率是92%,HNO3跟NH3反应生成NH4NO3。
(1)则制HNO3所用去的NH3的质量占总消耗NH3质量(不考虑生产上的其他损耗)的_______%。
(2)若由HNO3制NH4NO3时,NH3的吸收率为98%,则10 t NH3最多可制得______t NH4NO3,NH3应如何分配才能制得最多的NH4NO3?__________。
(3)若由HNO3制NH4NO3时,NH3的吸收率为98%,则制取10 t NH4NO3共需NH3________t。
(1)53.1
(2)21.9 NH3![]() HNO3用NH3 5.26 t, HNH3
HNO3用NH3 5.26 t, HNH3![]() NH4NO3用NH3 4.74 t
NH4NO3用NH3 4.74 t
(3)4.579
解析:
本题可据NH3![]() HNO3
HNO3![]() NH4NO3
NH4NO3
中NH3的转化量①=②求解。
(1)设制1 mol HNO3所用NH3为1 mol,则②中耗NH3为:1 mol×96%×92%=0.88 mol。
故制HNO3用去NH3的质量占总消耗NH3的质量分数为:
![]() ×100%=53.1%。
×100%=53.1%。
(2)设①用NH3的质量为x,则②用NH3的质量为10 t-x。
根据NH3转化量①=②有:x×96%×92%=(10-x)×98%
x=5.26 t10 t -5.26 t=4.74 t。
NH3 ~ NH4NO3
17 80
4.74 t×98% a
故最多可制得NH4NO3:a=4.74 t×98%×![]() =21.9 t。
=21.9 t。
(3)NH3转化量①=②为:10 t×![]() =2.125 t
=2.125 t
①中用NH3:2.125 t÷(96%×92%)=2.406 t
②用NH3:2.125 t÷98%=2.173 t
共需NH3:2.406 t+2.173 t=4.579 t。

化学肥料在农业生产中具有重要的作用,关系着农业生产是否丰收。化学肥料在农业生产中的广泛应用,为化学肥料的大规模工业生产提供了舞台。
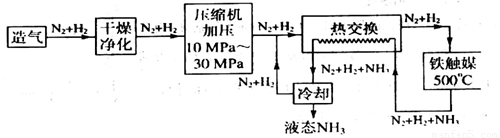
(1)在合成氨的设备(合成塔)中,设置热交换器的目的是______________。
(2)生产硝酸的过程中常会产生一些氮的氧化物,一般可采用下列两种方法处理。
碱液吸收法:NO+NO2+2NaOH=2NaNO2+H2O
氨还原法:8NH3+6NO2 7N2+12H2O(NO也有类似的反应)
7N2+12H2O(NO也有类似的反应)
请从绿色化学的角度分析两种方法的优劣:____________________。
(3)某化肥厂用NH3制备NH4NO3。已知:由NH3制NO的产率是96%,NO制HNO3的产率是92%,则制HNO3所用去的NH3的质量占总耗用NH3质量(不考虑其他损耗)的________%。
(4)硝酸铵是一种常用的氮肥,在贮存和使用该化肥时,把应注意的事项及理由填入下表(填两条应注意的事项及理由即可)。
|
|
注意事项 |
理由 |
|
① |
______________ |
____________ |
|
② |
________________ |
____________ |