题目内容
把锌片和铁片放在盛有稀食盐和酚酞混合液的U形管中,如图所示,最终可在A极观察到酚酞变红.A是原电池的正极还是负极?是锌还是铁?写出电极反应和总反应式.
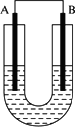
答案:
解析:
解析:
|
答案:A是正极,Fe作正极材料. 负极:2Zn-4e- 正极:O2+4e-+2H2O 总反应:2Zn+O2+2H2O 解析:这个装置是原电池,Zn作原电池的负极,Fe作正极,负极发生氧化反应:Zn-2e- 要点提示:之所以有电流通过,是因为发生了原电池反应,而不是材料与电解质之间发生了氧化还原反应,这样只能判断是发生了电化学腐蚀,在中性条件下发生吸氧腐蚀. |

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
把锌片和铁片放在盛有食盐水和酚酞的表面皿中,如图所示。
最先观察到酚酞变红的现象的区域是
| A.I和III | B.I和IV |
| C.II和III | D.II和IV |
把锌片和铁片放在盛有稀食盐水和酚酞试液混合溶液的玻璃皿中(如图所示平面图),经过一段时间后,两个实验中,首先观察到溶液变红的区域是( )
| A.Ⅰ和Ⅲ附近 | B.Ⅰ和Ⅳ附近 | C.Ⅱ和Ⅲ附近 | D.Ⅱ和Ⅳ附近 |
 2Zn2+
2Zn2+ 4OH-
4OH- 2Zn(OH)2
2Zn(OH)2 Zn2+,正极上发生还原反应:2H2O+O2+4e-
Zn2+,正极上发生还原反应:2H2O+O2+4e- 4OH-,所以正极附近OH-浓度变大,使酚酞变红.
4OH-,所以正极附近OH-浓度变大,使酚酞变红.
 把锌片和铁片放在盛有稀食盐水和酚酞试液混合溶液的玻璃皿中(如图所示平面图),经过一段时间后,首先观察到溶液变红的区域是( )
把锌片和铁片放在盛有稀食盐水和酚酞试液混合溶液的玻璃皿中(如图所示平面图),经过一段时间后,首先观察到溶液变红的区域是( )