题目内容
2.(1)m g H2O2中含有n个氧原子,则阿伏伽德罗常数可用m、n表示为NA=$\frac{17n}{m}$;(2)在标准状况下,11.2LCO和CO2混合气体的质量为20.4g,则混合气体中CO和CO2的物质的量之比为1:4.
分析 (1)依据n=$\frac{m}{M}$=$\frac{N}{{N}_{A}}$计算分析;
(2)令CO和CO2的物质的量分别为amol、bmol,根据二者的质量与体积列方程,计算a、b的值,再根据m=nM计算CO的质量.
解答 解:(1)m g H2O2中含有n个氧原子,则$\frac{mg}{34g/mol}$×2=$\frac{n}{{N}_{A}}$,计算得到NA=$\frac{17n}{m}$,故答案为:$\frac{17n}{m}$;
(2)标准状况下CO和CO2混合气体的体积为11.2L,物质的量为:$\frac{11.2L}{22.4L/mol}$=0.5mol,令CO和CO2的物质的量分别为amol、bmol,则:
$\left\{\begin{array}{l}{a+b=0.5}\\{28a+44b=20.4}\end{array}\right.$
解得:a=0.1,b=0.4
所以混合气体中CO和CO2的物质的量之比为1:4,
故答案为:1:4.
点评 本题考查混合物的计算、常用化学计量有关计算等,比较基础,注意公式的利用与基础知识的理解掌握.

练习册系列答案
相关题目
12.下列事实不能用勒夏特利原理来解释的是( )
| A. | 用排饱和食盐水的方法收集氯气 | |
| B. | 合成氨工业选择高温(合成氨反应为放热反应) | |
| C. | 增大压强,有利于SO2和O2反应生成SO3 | |
| D. | 在Fe3++3SCN-?Fe(SCN)3反应达平衡时,增加KSCN的浓度,体系颜色变深 |
10.①钠比水轻;②钠的熔点较低;③钠的硬度小;④钠与水反应放热;⑤钠与水反应后溶液呈碱性.某学生用小刀切一小块钠投入滴有酚酞试液的水中,据此实验能证明上述五点性质中的( )
| A. | ①②③ | B. | ③④⑤ | C. | ①②④⑤ | D. | ①②③④⑤ |
17.下列说法正确的是( )
| A. | 固体溶解后,将溶液转移到容量瓶中,然后向容量瓶中直接加水稀释到刻度线 | |
| B. | 分液操作时,分液漏斗中下层液体从下口放出,上层液体也从下口放出 | |
| C. | 蒸馏时,温度计水银球靠近蒸馏烧瓶的支管口处,且冷却水从冷凝管的下口通入上口流出 | |
| D. | 将5.85gNaCl固体溶于1 L水中可配成0.1 mol•L-1的NaCl溶液 |
7.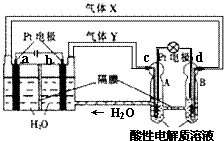 “天宫一号”RFC供电系统是一种将水电解技术与氢氧燃料电池技术相结合的可充放电池.如图为RFC工作原理示意图,有关说法正确的是( )
“天宫一号”RFC供电系统是一种将水电解技术与氢氧燃料电池技术相结合的可充放电池.如图为RFC工作原理示意图,有关说法正确的是( )
 “天宫一号”RFC供电系统是一种将水电解技术与氢氧燃料电池技术相结合的可充放电池.如图为RFC工作原理示意图,有关说法正确的是( )
“天宫一号”RFC供电系统是一种将水电解技术与氢氧燃料电池技术相结合的可充放电池.如图为RFC工作原理示意图,有关说法正确的是( )| A. | 当转移0.1 mol电子,a极产生2.24 L H2 | |
| B. | b电极反应是:4H2O+4e-═2H2↑+4OH- | |
| C. | d电极反应是:O2+4H++4e-═2H2O | |
| D. | c极上发生还原反应,B中H+经隔膜进入A |
12.如图两瓶体积相等的气体,在同温同压时瓶内气体的关系一定正确的是( )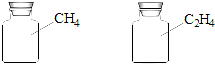

| A. | 所含原子数相等 | B. | 所含氢原子数相等 | ||
| C. | 所含分子数相等 | D. | 气体密度相等 |
 针对网络上流传的隔夜熟肉中因亚硝酸钠(NaNO2)含量严重超标而不能食用的说法,某兴趣小组开展如下探究活动:
针对网络上流传的隔夜熟肉中因亚硝酸钠(NaNO2)含量严重超标而不能食用的说法,某兴趣小组开展如下探究活动: