题目内容
肼(N2H4)又称联氨,是一种可燃性液体,与氧气或氮氧化物反应均可生成氮气和水,用作火箭燃料。
(1)写出肼与一氧化氮反应的化学方程式 。
(2)肼――空气燃料电池是一种碱性燃料电池,电解质溶液是20%―30%的KOH溶液。该电池放电时,负极的电极反应式是 。
(3)下图是一个电化学装置示意图。用肼――空气燃料电池做此装置的电源。

①如果A为含有铁、银、金、碳等杂质的粗铜,B为纯铜,C为CuSO4。通电一段时间后,溶液中Cu2+的浓度将 填“增大”、“减小”或“不变”)。
②如果A是铂电极,B是石墨电极,C是硫酸性,阴极的电极反应式是 。利用该装置可制得少量过氧化氢:在阳极上SO42―被氧化成S2O82―(过二氧酸根离子)S2O82―与H2O反应生成H2O2,S2O82―+2H2O=2S2O42―+H2O2+2H+。若要制取1molH2O2,该燃料电池理论上需消耗 molN2H4。
(1)N2H2+2NO=2N2+2H2O
(2)N2H2+4OH―→N2+4H2O+4e―
(3)①减小
②2H++2e―→H2↑ 0.5

练习册系列答案
 优等生题库系列答案
优等生题库系列答案 53天天练系列答案
53天天练系列答案
相关题目
 肼(N2H4)又称联氨,是一种可燃性液体,与氧气或氮氧化物反应均可生成氮气和水,用作火箭燃料.
肼(N2H4)又称联氨,是一种可燃性液体,与氧气或氮氧化物反应均可生成氮气和水,用作火箭燃料. 肼(N2H4)又称联氨,广泛用于火箭推进剂、有机合成及燃料电池,NO2的二聚体N2O4则是火箭中常用的氧化剂,请回答下列问题:
肼(N2H4)又称联氨,广泛用于火箭推进剂、有机合成及燃料电池,NO2的二聚体N2O4则是火箭中常用的氧化剂,请回答下列问题:
 肼(N2H4)又称联氨,是一种可燃性液体,用作火箭燃料.
肼(N2H4)又称联氨,是一种可燃性液体,用作火箭燃料.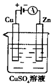 肼(N2H4)又称联氨,可用作火箭燃料.肼一空气燃料电池中的电解质溶液是20%~30%的KOH溶液.该燃料电池可作为如图装置中的电源.下列判断错误的是( )
肼(N2H4)又称联氨,可用作火箭燃料.肼一空气燃料电池中的电解质溶液是20%~30%的KOH溶液.该燃料电池可作为如图装置中的电源.下列判断错误的是( )