题目内容
3.二氧化碳被认为是加剧温室效应的主要来源.质量相同的下列物质完全燃烧时所产生的温室效应最小的是( )| A. | 甲烷 | B. | 乙烯 | C. | 乙炔 | D. | 乙醇 |
分析 二氧化碳被认为是加剧温室效应的主要来源,相同质量的有机物含碳量越低,完全燃烧生成二氧化碳的量越少,产生的温室效应越小,据此解答.
解答 解:二氧化碳被认为是加剧温室效应的主要来源,相同质量的有机物含碳量越低,完全燃烧生成二氧化碳的量越少,产生的温室效应越小,
甲烷中碳的百分含量为$\frac{12}{16}$×100%=75%;
乙烯中碳的百分含量为$\frac{24}{27}$×100%=85.7%;
乙炔中碳的百分含量为$\frac{24}{26}$×100%=92.3%;
乙醇中碳的百分含量为$\frac{24}{46}$×100%=52.2%;
所以质量相同的下列物质完全燃烧时所产生的温室效应最小的是乙醇,
故选:D.
点评 本题考查了温室效应的产生,明确物质含碳量高低是解题关键,题目难度不大.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
13.假定元素周期表是有限的,根据已知的元素周期表的某些事实和理论可归纳出一些假说.

(1)已知元素周期表中的各周期可排元素种类如下:
人们预测元素周期表第八周期将来也会排满,那么该周期排满后的元素种数是50.
A.18 B.32 C.50 D.无法判断
(2)根据周期表中每个周期非金属元素的种数(把稀有气体元素看做非金属元素),预测周期表中应该有23种非金属元素,还有1种未发现.未发现的非金属元素处于七周期0族.
(3)小明同学所在的化学探究小组,在查阅相关资料后归纳出元素周期表的另一种画法--三角形元素周期表的一部分,图上标有第ⅦA族和碳、钾两种元素的位置.
回答下列问题:
①请在图中将过渡元素所在的位置涂黑.
②画出B元素价电子排布图 .
.

(1)已知元素周期表中的各周期可排元素种类如下:
| 周期 | 1 | 2 | 3 | 4 | 5 | 6 | 7 |
| 元素种类 | 2 | 8 | 8 | 18 | 18 | 32 | 32 |
A.18 B.32 C.50 D.无法判断
(2)根据周期表中每个周期非金属元素的种数(把稀有气体元素看做非金属元素),预测周期表中应该有23种非金属元素,还有1种未发现.未发现的非金属元素处于七周期0族.
(3)小明同学所在的化学探究小组,在查阅相关资料后归纳出元素周期表的另一种画法--三角形元素周期表的一部分,图上标有第ⅦA族和碳、钾两种元素的位置.
回答下列问题:
①请在图中将过渡元素所在的位置涂黑.
②画出B元素价电子排布图
 .
.
14.甲、乙、丙、丁分别是Na2CO3、AgNO3、BaCl2、盐酸四种无色溶液中的一种,它们两两反应后的现象如下:甲+乙→沉淀; 甲+丙→沉淀; 乙+丙→沉淀; 丙十丁→沉淀;乙+丁→无色无味气体.则甲、乙、丙、丁四种溶液依次是( )
| A. | BaCl2 Na2CO3 AgNO3 盐酸 | B. | BaCl2 Na2CO3 盐酸 AgNO3 | ||
| C. | Na2CO3 盐酸 AgNO3 BaCl2 | D. | AgNO3 盐酸 BaCl2 Na2CO3 |
11.在一定条件下,按下列物质的量关系进行反应,其对应的离子方程式或化学方程式书写正确的是( )
| A. | n(Cl2):n(Fe)=5:4 5Cl2+4Fe$\frac{\underline{\;点燃\;}}{\;}$2FeCl2+2FeCl3 | |
| B. | n(Cl2):n(FeBr2)=1:1 Fe2++2Br-+Cl2═Fe3++Br2+2Cl- | |
| C. | n(MnO4-):n(H2O2)=2:3 2MnO4-+3H2O2+6H+═2Mn2++4O2↑+6H2O | |
| D. | n(Fe):n(HNO3(稀))═1:3 4Fe+12H++3NO3-=3Fe2++Fe3++3NO↑+6H2O |
18.表是元素周期表的一部分,针对表中的①~⑩种元素,填写下列空白:
(1)在下列横线上填写“大于”、“小于”、“等于”.
第一电离能:②大于③;电负性:②小于③;非金属性:①小于⑦;离子半径:④小于⑥.
(2)在最高价氧化物的水化物中,酸性最强的化合物的化学式为:HClO4;碱性最强的化合物的电子式为: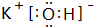 .
.
(3)最高价氧化物是两性氧化物的元素是Al (填元素符号);写出其最高价氧化物与⑨的最高价氧化的水化物反应的离子方程式Al2O3+2OH-═2AlO2-+H2O.
| 主族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0族 |
| 2 | ⑩ | ① | ② | ③ | ||||
| 3 | ④ | ⑤ | ⑥ | ⑦ | ⑧ | |||
| 4 | ⑨ |
第一电离能:②大于③;电负性:②小于③;非金属性:①小于⑦;离子半径:④小于⑥.
(2)在最高价氧化物的水化物中,酸性最强的化合物的化学式为:HClO4;碱性最强的化合物的电子式为:
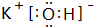 .
.(3)最高价氧化物是两性氧化物的元素是Al (填元素符号);写出其最高价氧化物与⑨的最高价氧化的水化物反应的离子方程式Al2O3+2OH-═2AlO2-+H2O.
12.下列叙述比较严谨的是( )
| A. | 将两种带相反电荷的胶体混合,能发生聚沉 | |
| B. | 有化学键断裂的变化一定是化学变化 | |
| C. | IA族元素形成的单质的熔点随原子序数的递增而降低 | |
| D. | 碱性氧化物一定是金属氧化物 |