��Ŀ����
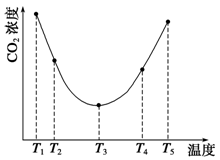
(9��)��֪A(g)+B(g)  C(g)+D(g)��Ӧ��ƽ�ⳣ�����¶ȵĹ�ϵ���£�
C(g)+D(g)��Ӧ��ƽ�ⳣ�����¶ȵĹ�ϵ���£�
| |�¶�/ �� | 700 | 900 | 830 | 1000 | 1200 |
| ƽ�ⳣ�� | 1.7 | 1.1 | 1.0 | 0.6 | 0.4 |
(1)�÷�Ӧ��ƽ�ⳣ������ʽK= ����H 0���<���� >���� =��)��
(2)830��ʱ����һ��5 L���ܱ������г���0.20mol��A��0.80mol��B���練Ӧ��ʼ6s��A��ƽ����Ӧ����v(A)=0��003 mol��L-1��s-1����6sʱc(A)= mol��L-1�� C�����ʵ���Ϊ mol������Ӧ��һ��ʱ��ﵽƽ��ʱA��ת����Ϊ �������ʱ����ܱ��������ٳ���1 mol�����ƽ��ʱA��ת����Ϊ ��
(3)�жϸ÷�Ӧ�Ƿ�ﵽƽ�������Ϊ (����ȷѡ��ǰ����ĸ)��
a��ѹǿ����ʱ��ı� b��������ܶȲ���ʱ��ı�
c��c(A)����ʱ��ı� d����λʱ��������C��D�����ʵ������
(4)1200��ʱ��ӦC(g)+D(g)
 A(g)+B(g)��ƽ�ⳣ����ֵΪ ��
A(g)+B(g)��ƽ�ⳣ����ֵΪ ��
����1�� ��<����2��0.022��0.09��80%��80%����3��c����4��2.5��
��<����2��0.022��0.09��80%��80%����3��c����4��2.5��
����

(14��)
�������ڹ�ҵ�������й㷺����;��
��1�����ڿ��淴Ӧ2SO2(g)��O2(g)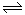 2SO3(g) ��H��0�������о�Ŀ�ĺ�ͼʾ�������
2SO3(g) ��H��0�������о�Ŀ�ĺ�ͼʾ�������
������ţ�
| ��� | A | B | C | D |
| Ŀ�� | ѹǿ��ƽ���Ӱ�� | �¶ȶ�ת���ʵ�Ӱ�� | ����O2Ũ�ȶ����ʵ�Ӱ�� | Ũ�ȶ�ƽ�ⳣ����Ӱ�� |
| ͼʾ | 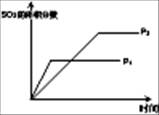 |  | 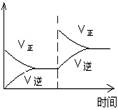 | 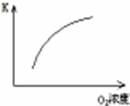 |
�ҡ����>����<����="��" ��
��3����2L�ļ������г���2molSO2��1molO2�����SO2��ƽ��ת�������¶ȵĹ�ϵ����ͼ��ʾ��
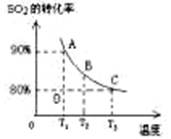
��.��T1�¶��£���Ӧ���е�״̬Dʱ��v�� v�������>����<����="��" ��
��.T3�¶��£�ƽ��ʱ��÷�Ӧ�ų�������ΪQ1������ͬ�¶���������������ͨ��2molSO2��1molO2�����´ﵽƽ�⣬��÷�Ӧ�ַų�����Q2 ��������˵������ȷ���� ��������ţ�
A����ͬ�¶�����ƽ��ʱ�����е�ѹǿ��ԭƽ��ʱ������
B��Q2һ������Q1
C����ƽ��ʱSO2��ת����һ������80%
��
��4���ڼ������г���һ������SO2��1.100molO2���ڴ��������¼��ȣ�����������ʵ�������0.315molʱ��Ӧ�ﵽƽ�⣬��ʱ�������ѹǿΪ��Ӧǰ��82.5%����SO2��ת����Ϊ ��
����5����������������Һ����SO2����ǡ�õõ���ʽ�Σ���֪����ʽ����Һ�������ԣ�����Һ�и�����Ũ���ɴ�С��˳��Ϊ ����������Ũ�ȷ��ű�ʾ��
����6��һ���¶��£���ˮ����SO2���壬���õ�pH=5��H2SO3��Һ������Һ��������������Ӻ�����������ӵ����ʵ���Ũ��֮��Ϊ ���� ������֪���¶���H2SO3�ĵ��볣����Ka1=1.0��10-2mol/L��Ka2=6.0��10-3mol/L��
ú��������úΪԭ�ϣ�������ѧ�ӹ�ʹúת��Ϊ���塢Һ�塢����ȼ���Լ����ֻ�����Ʒ�Ĺ�ҵ���̡�
��1����ˮ����ͨ�����ȵ�̿���ɲ���ˮú������ӦΪ��C(s)��H2O(g)  CO(g)��H2(g) ��H����131.3 kJ��mol��1һ���¶��£���һ���ݻ��ɱ���ܱ������У�����������Ӧ���������жϸ÷�Ӧ�ﵽ��ѧƽ��״̬���� (����ĸ����ͬ)
CO(g)��H2(g) ��H����131.3 kJ��mol��1һ���¶��£���һ���ݻ��ɱ���ܱ������У�����������Ӧ���������жϸ÷�Ӧ�ﵽ��ѧƽ��״̬���� (����ĸ����ͬ)
A�������е�ѹǿ����
B��1 mol H��H�����ѵ�ͬʱ����2 mol H��O��
C��v��(CO)��v��(H2O)
D��c(CO)��c(H2)
��2������ͬ����CO(g)��H2O(g)�ֱ�ͨ�뵽���Ϊ2 L�ĺ����ܱ������У����з�ӦCO(g)��H2O(g)  CO2(g)��H2(g)���õ������������ݣ�
CO2(g)��H2(g)���õ������������ݣ�
| ʵ �� �� | �� �� /�� | ��ʼ��/mol | ƽ����/mol | �ﵽƽ������ʱ��/min | ||
| H2O | CO | H2 | CO | |||
| 1 | 650 | 2 | 4 | 1.6 | 2.4 | 5 |
| 2 | 900 | 1 | 2 | 0.4 | 1.6 | 3 |
| 3 | 900 | a | b | c | d | t |
�ٸ÷�Ӧ���淴ӦΪ (������š�)�ȷ�Ӧ��
����ʵ��3Ҫ�ﵽ��ʵ��2��ͬ��ƽ��״̬(�������ʵ����������ֱ����)����t<3 min����a��bӦ����Ĺ�ϵ�� (�ú�a��b����ѧʽ��ʾ)��
(3)Ŀǰ��ҵ����һ�ַ�������CO2�������״���һ�������·�����Ӧ��CO2(g)+3H2(g)
 CH3OH(g) +H2O(g)����ͼ��ʾ�÷�Ӧ���й���������(��λΪkJ��mol��1)�ı仯�������Ϊ1 L�ĺ����ܱ������У�����1 mol CO2��3 mol H2�� ���д�ʩ����ʹ c(CH3OH)�������
CH3OH(g) +H2O(g)����ͼ��ʾ�÷�Ӧ���й���������(��λΪkJ��mol��1)�ı仯�������Ϊ1 L�ĺ����ܱ������У�����1 mol CO2��3 mol H2�� ���д�ʩ����ʹ c(CH3OH)������� 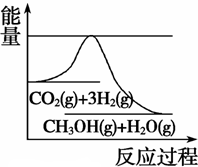
A�������¶�
B������N2(g)��ʹ��ϵѹǿ����
C����H2O(g)����ϵ�з������
D���ٳ���0.5 mol CO2��1.5 mol H2
��������ЧӦ����Դ��ȱ�����⣬��ν��ʹ����е�CO2���������Կ������ã������˸�����ձ����ӡ�Ŀǰ��ҵ����һ�ַ�������CO2����ȼ�ϼ״���һ�������·�����Ӧ��CO2(g)��3H2(g)  CH3OH(g)��H2O(g)���÷�Ӧ�������仯��ͼ��ʾ��
CH3OH(g)��H2O(g)���÷�Ӧ�������仯��ͼ��ʾ��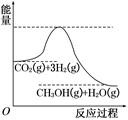
(1)������Ӧƽ�ⳣ��K�ı���ʽΪ ���¶Ƚ��ͣ�ƽ�ⳣ��K (����������䡱��С��)��
(2)�����Ϊ2 L���ܱ������У�����1 mol CO2��3 mol H2�����CO2�����ʵ�����ʱ��仯���±���ʾ���ӷ�Ӧ��ʼ��5 minĩ��������Ũ�ȱ仯��ʾ��ƽ����Ӧ����v(H2)�� ��
| t/min | 0 | 2 | 5 | 10 | 15 |
| n(CO2)/mol | 1 | 0.75 | 0.5 | 0.25 | 0.25 |
(3)����������ʹ������Ӧ�ķ�Ӧ����������ƽ��������Ӧ�����ƶ����� (��д�����ĸ)
a����ʱ�����CH3OH����
b���ʵ������¶�
c�������������ݻ����䣬�ٳ���1 mol CO2��3 mol H2
d��ѡ���Ч����
 (NH4)2CO3(aq) ��H1
(NH4)2CO3(aq) ��H1
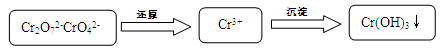
 Cr2O72- + H2O
Cr2O72- + H2O
 ��2H2O��
��2H2O�� CH3OH(g)+H2O(g)���жϸ÷�Ӧ�Ѵﻯѧ��Ӧ�ȱ�־���� ������ĸ����
CH3OH(g)+H2O(g)���жϸ÷�Ӧ�Ѵﻯѧ��Ӧ�ȱ�־���� ������ĸ����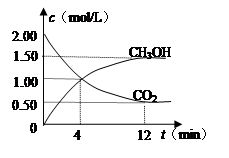
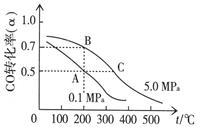
 CH3OH(g)����֪�ܱ������г���10 mol CO��20 mol H2��CO��ƽ��ת���ʣ��������¶ȡ�ѹǿ�Ĺ�ϵ������ͼ��ʾ��
CH3OH(g)����֪�ܱ������г���10 mol CO��20 mol H2��CO��ƽ��ת���ʣ��������¶ȡ�ѹǿ�Ĺ�ϵ������ͼ��ʾ�� cC(g) + dD(g) ����Ӧʱ����C%(����C���������)������ϵ��ͼ��ʾ��Aͼ��ʾ�����¶Ȳ�ͬ�����ߣ�Bͼ��ʾѹǿ��ͬ�����ߣ�Cͼ��ʾʹ�ô����Ͳ�ʹ�ô���ʱ�ķ�Ӧ���ߡ�
cC(g) + dD(g) ����Ӧʱ����C%(����C���������)������ϵ��ͼ��ʾ��Aͼ��ʾ�����¶Ȳ�ͬ�����ߣ�Bͼ��ʾѹǿ��ͬ�����ߣ�Cͼ��ʾʹ�ô����Ͳ�ʹ�ô���ʱ�ķ�Ӧ���ߡ�
 H2����I2
H2����I2