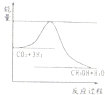
题目内容
能正确表示下列化学反应的离子方程式是( )
| A.氧化铜与稀硫酸反应:O2-+2H+=H2O |
| B.稀H2SO4与铁粉反应:2Fe+6H+=2Fe3++3H2↑ |
| C.铜片插入硝酸银溶液中Cu+Ag+=Cu2++Ag |
| D.硫酸溶液与氢氧化钡溶液的反应2H++SO42-+Ba2++2OH-=BaSO4↓+2H2O |
A、氧化铜与稀硫酸反应为:CuO+2H+=H2O+Cu2+,氧化铜在离子反应中不能拆成离子形式,故A错误;
B、铁和稀硫酸反应生成的是硫酸亚铁和氢气,即Fe+2H+=Fe2++H2↑,故B错误;
C、铜片插入硝酸银溶液中的反应为:Cu+2Ag+=Cu2++2Ag,离子反应要遵循电荷守恒,故C错误;
D、硫酸溶液与氢氧化钡溶液混合后,硫酸根离子和钡离子、氢氧根离子和氢离子之间均反应,即2H++SO42-+Ba2++2OH-=BaSO4↓+2H2O,故D正确.
故选D.
B、铁和稀硫酸反应生成的是硫酸亚铁和氢气,即Fe+2H+=Fe2++H2↑,故B错误;
C、铜片插入硝酸银溶液中的反应为:Cu+2Ag+=Cu2++2Ag,离子反应要遵循电荷守恒,故C错误;
D、硫酸溶液与氢氧化钡溶液混合后,硫酸根离子和钡离子、氢氧根离子和氢离子之间均反应,即2H++SO42-+Ba2++2OH-=BaSO4↓+2H2O,故D正确.
故选D.

练习册系列答案
 A加金题 系列答案
A加金题 系列答案 全优测试卷系列答案
全优测试卷系列答案
相关题目
在下列各说法中,正确的是( )
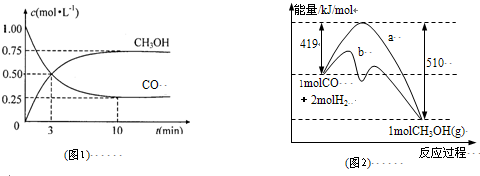
| A、对于2SO2(g)+O2(g)?2SO3(g)△H=-QkJ?mol-1,(Q>0),若反应中充入1molSO2和足量的氧气反应时,放出的热量一定是Q/2 kJ | B、热化学方程式中的化学计量数不能用分数表示 | C、Zn(s)+H2SO4(aq)═ZnSO4(aq)+H2(g)△H<0,该反应的化学能可以转化为电能 | D、△H的大小与热化学方程式的化学计量数无关 |
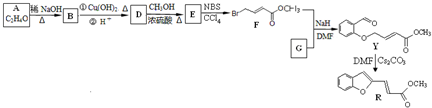
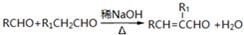 (R、R1表示烃基或氢)
(R、R1表示烃基或氢)
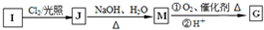


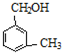 互为同系物
互为同系物