题目内容
下列电离方程式书写正确的是
- A.CH3COONH4═CH3COO-+NH4+
- B.HI=H++I-
- C.H2S═2H++S2-
- D.NaHCO3=Na++H++CO32-
AB
分析:先判断电解质,强电解质的电离用等号,弱电解质的电离用可逆号,并遵循质量守恒定律和电荷守恒,注意弱酸的酸根离子应保留整体,以此来解答.
解答:A.CH3COONH4为强电解质,电离方程式为CH3COONH4═CH3COO-+NH4+,故A正确;
B.HI为强酸,则电离方程式为HI═H++I-,故B正确;
C.H2S为弱酸,则电离方程式为H2S?H++HS-,HS-?H++S2-,故C错误;
D.NaHCO3为强电解质,则电离方程式为NaHCO3═Na++HCO3-,故D错误;
故选AB.
点评:本题考查电解质的电离方程式,明确电解质的强弱及电离方程式书写的方法即可解答,难度不大.
分析:先判断电解质,强电解质的电离用等号,弱电解质的电离用可逆号,并遵循质量守恒定律和电荷守恒,注意弱酸的酸根离子应保留整体,以此来解答.
解答:A.CH3COONH4为强电解质,电离方程式为CH3COONH4═CH3COO-+NH4+,故A正确;
B.HI为强酸,则电离方程式为HI═H++I-,故B正确;
C.H2S为弱酸,则电离方程式为H2S?H++HS-,HS-?H++S2-,故C错误;
D.NaHCO3为强电解质,则电离方程式为NaHCO3═Na++HCO3-,故D错误;
故选AB.
点评:本题考查电解质的电离方程式,明确电解质的强弱及电离方程式书写的方法即可解答,难度不大.

练习册系列答案
 口算能手系列答案
口算能手系列答案
相关题目
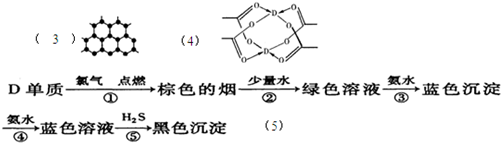
 (2009?安徽模拟)A、B、C、D、E五种短周期元素,原子序数依次增大,A、E同主族,A元素的原子半径最小,B元素原子的最外层电子数是内层电子数的2倍,C元素原子的电子层数为n,最外层电子数为2n+1,A、B、C、E每种元素都能与D元素组成两种或两种以上的常见化合物.回答下列问题:
(2009?安徽模拟)A、B、C、D、E五种短周期元素,原子序数依次增大,A、E同主族,A元素的原子半径最小,B元素原子的最外层电子数是内层电子数的2倍,C元素原子的电子层数为n,最外层电子数为2n+1,A、B、C、E每种元素都能与D元素组成两种或两种以上的常见化合物.回答下列问题: